Что значит летучая кислота
Уроки по неорганической химии для подготовки к ЕГЭ
Свойства простых веществ:
Свойства сложных веществ:
Особенности протекания реакций:
Химические свойства кислот
1. Сила кислот уменьшается в ряду:
Некоторые реакции, подтверждающие ряд кислот:
Во всех этих реакциях образуются либо осадок, либо (более) слабая кислота.
Если осадка не образуется и обе кислоты сильные (т.е. кислота, которая вступила в реакцию, и кислота, которая образовалась в результате реакции), то в растворе такие реакции не идут. Подобные реакции возможны только в случае образования сильных летучих кислот (HNO3 и HCl) в реакциях с твердыми солями, а не растворами:
Аналогичным образом можно получить и слабую плавиковую кислоту:
HBr и HI (они также являются летучими) таким образом получать не удается, так как они окисляются концентрированной серной кислотой:
2. Летучесть кислот
Следующие кислоты являются летучими: HNO3, HF, HCl, HBr, HI, H2S, H2Se.
Остальные кислоты являются нелетучими.
3. Сила кислот (способность к диссоциации)
4. Растворимость кислот в воде
Нерастворимыми кислотами являются: H2SiO3 и все высшие жирные кислоты, т.е. кислоты, содержащие 10 атомов углерода и больше. Например, C17H35COOH (стеариновая кислота).
5. Термическое разложение кислот
При нагревании разлагаются следующие кислоты:
6. Взаимодействие с основаниями (реакция нейтрализации)
Эти реакции идут, только если образующаяся соль существует в водном растворе, т.е. в таблице растворимости не должен стоять прочерк:
H2S + Al(OH)3 → реакция не идет, т.к. Al2S3 в водной среде разлагается (по сути, идет обратная реакция)
H2S + Cr(OH)3 → реакция не идет по той же причине.
Особенность кремниевой кислоты: из оснований она реагирует только с щелочами:
7. Взаимодействие с солями
Реакции с солями идут, если выделяется газ, выпадает осадок или образуется более слабая кислота:
8. Взаимодействие кислот-неокислителей с металлами
Металлы, стоящие в ряду активности металлов до водорода, взаимодействуют с кислотами-неокислителями с выделением водорода:
Кислоты, их классификация
Урок 38. Химия 8 класс
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Кислоты, их классификация»
Существует несколько признаков классификации кислот. Разберем некоторые их них. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотных остатков.
По наличию атомов кислорода в кислотах, кислоты делятся на кислородсодержащие, в которых присутствует кислород, например, серная кислота, азотная кислоты, бескислородные, в которых кислорода нет, к таким кислотам относится соляная, сероводородная.
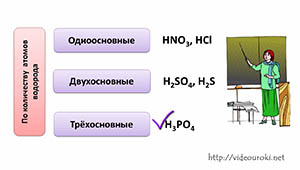
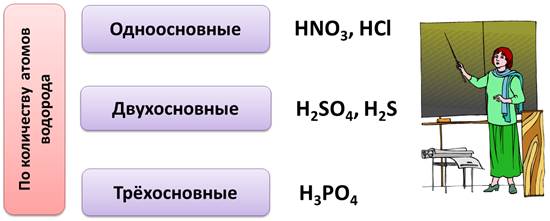
По количеству атомов водорода в кислоте, кислоты делятся на однооснòвные, у которых один атом водорода (например, в азотной кислоте, соляной), двухоснòвные, у которых 2 атома водорода (как в серной кислоте или сероводородной), трёхоснòвные, у которых 3 атома водорода (как в фосфорной кислоте).
По растворимости в воде кислоты делятся на растворимые в воде, к ним относится большинство кислот и нерастворимые в воде, как кремниевая кислота.
По летучести, т.е. способности молекул кислоты легко переходить в газообразное состояние, кислоты делятся на летучие (как соляная, сероводородная и азотная кислоты) и нелетучие – это большинство кислот: серная, кремниевая, фосфорная.
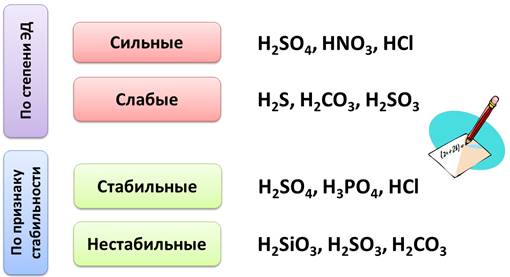
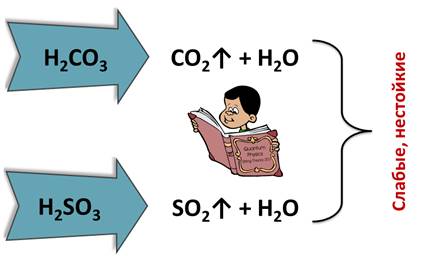
По степени электролитической диссоциации кислоты делятся на сильные, у которых степень электролитической диссоциации стремится к единице, к ним относятся такие кислоты, как серная, азотная, соляная, а слабые кислоты, у которых степень электролитической диссоциации стремится к нулю, например, сероводородная, угольная, сернистая.
По признаку стабильности кислоты делят на стабильные, как серная, фосфорная, соляная, и нестабильные, которые разлагаются при обычных условиях или при нагревании, это такие кислоты, как кремниевая, сернистая, угольная.
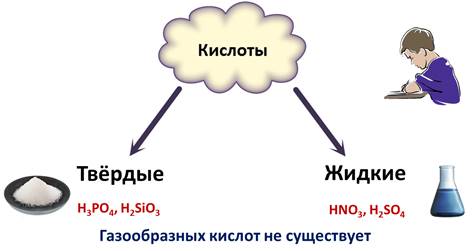
При обычных условиях кислоты могут быть твердыми. Это такие кислоты, как фосфорная и кремниевая. А также кислоты могут быть жидкими, как азотная, серная. Газообразных кислот при обычных условиях нет. Не путайте: соляную, сероводородную, бромоводородную кислоты образуют соответствующе газы, растворенные в воде, но они не являются газообразными кислотами.
Некоторые кислоты, такие как угольная и сернистая, существуют только в водных растворах, потому что они являются слабыми и нестойкими, они легко разлагаются на соответствующие оксиды и воду, поэтому выделить эти кислоты в чистом виде невозможно. Соляная кислота является летучей стабильной кислотой, а кремниевая кислота – нелетучей, нерастворимой и нестабильной кислотой, потому что при нагревании разлагается на оксид и воду.
Большинство водных растворов кислот не имеют окраски: серная, азотная, соляная и др., а хромовая (H2CrO4) имеет жёлтую окраску, марганцевая кислота (HMnO4) имеет малиновую окраску.
летучая кислота
Смотреть что такое «летучая кислота» в других словарях:
Кислота Синильная (Hydrocyanic Acid, Prussic Acid) — крайне ядовитая летучая кислота, вдыхание паров которой может привести к смерти в течение одной минуты. Имеет запах горького миндаля. См. Цианид. Источник: Медицинский словарь … Медицинские термины
КИСЛОТА СИНИЛЬНАЯ — (hydrocyanic acid, prussic acid) крайне ядовитая летучая кислота, вдыхание паров которой может привести к смерти в течение одной минуты. Имеет запах горького миндаля. См. Цианид … Толковый словарь по медицине
КИСЛОТА УКСУСНАЯ — Acidum aceticum. Свойства. Кислота уксусная официнальна в трех концентрациях: а) концентрированная ледяная) уксусная кислота, содержащая 96 100 % кислоты. Это бесцветная, прозрачная, летучая жидкость, застывающая при температуре ниже 0°С, смешив … Отечественные ветеринарные препараты
КИСЛОТА СОЛЯНАЯ — Acidum hydrochloricum. Синоним: кислота хлористоводородная. Свойства. Бесцветная прозрачная летучая жидкость своеобразного запаха, кислого вкуса. Смешивается с водой и спиртом во всех отношениях, образуя растворы кислой реакции. Удельный вес 1,1 … Отечественные ветеринарные препараты
КИСЛОТА ХЛОРИСТОВОДОРОДНАЯ — ( Аcidum hydrochloricu m). Синоним: Кислота соляная. Бесцветная прозрачная летучая жидкость со своеобразным запахом, кислым вкусом, смешивается с водой и спиртом во всех соотношениях, образуя, растворы сильно кислой реакции. Хранение: список Б. В … Словарь медицинских препаратов
СОЛЯНАЯ КИСЛОТА — (хлороводородная кислота, хлористоводородная кислота) сильная одноосновная летучая кислота с резким запахом, водный раствор хлористого водорода; максимальная концентрация 38% по массе, плотность такого раствора 1,19 г/см3. Применяют в… … Российская энциклопедия по охране труда
КАПРИНОВАЯ КИСЛОТА — Летучая жирная кислота, названная так по запаху, напоминающему запах козла. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. КАПРИНОВАЯ КИСЛОТА Летучая жирная кислота,… … Словарь иностранных слов русского языка
Хлорная кислота — Хлорная кислота … Википедия
Синильная кислота — Синильная кислота … Википедия
Азотистоводородная кислота — Азотистоводородная кислота … Википедия
Что значит летучая кислота
ПРОДУКТЫ ПЕРЕРАБОТКИ ФРУКТОВ И ОВОЩЕЙ
Метод определения летучих кислот
Fruit and vegetable products. Method for determination of volatile acids
Дата введения 2016-01-01
Предисловие
Цели, основные принципы и основной порядок проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0-92 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2-2009 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, применения, обновления и отмены»
Сведения о стандарте
1 РАЗРАБОТАН Некоммерческой организацией «Российский союз производителей соков» (РСПС)
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 29 августа 2014 г. N 69-П)
За принятие голосовали:
Краткое наименование страны по МК (ИСО 3166) 004-97
Сокращенное наименование национального органа по стандартизации
Минэкономики Республики Армения
Госстандарт Республики Беларусь
Госстандарт Республики Казахстан
4 Приказом Федерального агентства по техническому регулированию и метрологии от 16 сентября 2014 г. N 1093-ст межгосударственный стандарт ГОСТ 25555.1-2014 введен в действие в качестве национального стандарта Российской Федерации с 01 января 2016 г.
5 В настоящем стандарте учтены основные положения метода ИФУ 5:1987* (Rev.2005) «Определение летучих кислот» Международной федерации производителей фруктовых соков [IFU 5:1987 (Rev.2005) «Determination of Volatile Acids», International Federation of Fruit Juice Produces]
ВНЕСЕНА поправка*, опубликованная в ИУС N 2, 2016 год
* См. ярлык «Примечания».
Поправка внесена изготовителем базы данных
1 Область применения
Предел обнаружения метода 2·10 %.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие межгосударственные стандарты:
ГОСТ 12.0.004-90 Система стандартов безопасности труда. Организация обучения безопасности труда. Общие положения
ГОСТ 12.1.004-91 Система стандартов безопасности труда. Пожарная безопасность. Общие требования
ГОСТ 12.1.005-88 Система стандартов безопасности труда. Общие санитарно-гигиенические требования к воздуху рабочей зоны
ГОСТ 12.1.007-76 Система стандартов безопасности труда. Классификация и общие требования безопасности
ГОСТ 12.1.019-79 Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты*
* На территории Российской Федерации действует ГОСТ Р 12.1.019-2009 «Система стандартов безопасности труда. Электробезопасность. Общие требования и номенклатура видов защиты».
ГОСТ 12.4.009-83 Система стандартов безопасности труда. Пожарная техника для защиты объектов. Основные виды. Размещение и обслуживание
ГОСТ 61-75 Реактивы. Кислота уксусная. Технические условия
ГОСТ OIML R 76-1-2011 Государственная система обеспечения единства измерений. Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ 1770-74 (ИСО 1042-83, ИСО 4788-80) Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ ISO 3696-2013 Вода для лабораторного анализа. Технические требования и методы испытаний*
* На территории Российской Федерации действует ГОСТ Р 52501-2005 «Вода для лабораторного анализа. Технические условия».
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4919.1-77 Реактивы и особо чистые вещества. Методы приготовления растворов индикаторов
ГОСТ ИСО 5725-6-2003 Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике*
* На территории Российской Федерации действует ГОСТ Р ИСО 5725-6-2002 «Точность (правильность и прецизионность) методов и результатов измерений. Часть 6. Использование значений точности на практике».
ГОСТ 8682-93 Посуда лабораторная стеклянная. Шлифы конические взаимозаменяемые
ГОСТ 8756.0-70 Продукты пищевые консервированные. Отбор проб и подготовка их к испытанию*
* Заменен на ГОСТ 26313-84 в части плодоовощных консервированных продуктов; ГОСТ 26671-85 в части разд.4 в части продуктов переработки плодов и овощей.
ГОСТ 13341-77 Овощи сушеные. Правила приемки, методы отбора и подготовка проб
ГОСТ 14919-83 Электроплиты, электроплитки и жарочные электрошкафы бытовые. Общие технические условия
ГОСТ ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ 25336-82 Посуда и оборудование лабораторные. Типы. Основные параметры и размеры
ГОСТ 25555.5-91 Продукты переработки плодов и овощей. Методы определения диоксида серы
ГОСТ 25794.1-83 Реактивы. Методы приготовления титрованных растворов для кислотно-основного титрования
ГОСТ 26313-84 Продукты переработки плодов и овощей. Правила приемки, методы отбора проб
ГОСТ 26671-85 Продукты переработки плодов и овощей, консервы мясные и мясорастительные. Подготовка проб для лабораторных анализов
ГОСТ 29169-91 Посуда лабораторная стеклянная. Пипетки с одной отметкой
3 Сущность метода
Метод основан на выделении летучих кислот уксуснокислого ряда (уксусной, пропионовой и др.) путем отгона с водяным паром и титровании полученного дистиллята раствором гидроокиси натрия в присутствии фенолфталеина в качестве индикатора.
4 Средства измерений, вспомогательное оборудование, посуда, реактивы и материалы
Весы неавтоматического действия по ГОСТ OIML R 76-1 II класса точности с наибольшим пределом взвешивания 500 г и ценой поверочного деления 0,01 г.
Микробюретка вместимостью 10 см с ценой деления 0,02 см по нормативным документам государств, принявших стандарт.
Пипетки с одной меткой 2-2-2, 2-2-10, 2-2-20 и 2-2-100 по ГОСТ 29169.
Воронки стеклянные по ГОСТ 25336.
Колбы мерные 2-1000-2 по ГОСТ 1770.
Горелки газовые или электроплитки бытовые по ГОСТ 14919.
Колбонагреватель электрический с регулировкой температуры по нормативным документам государств, принявших стандарт.
Секундомер любого типа, обеспечивающий измерение времени с точностью не менее 0,2 с.
Установка для перегонки летучих кислот (см. рисунок 1), состоящая:
— из колбы круглодонной вместимостью 1000 см по ГОСТ 25336;
— колбы круглодонной с двумя горловинами с шлифами КГУ-2-1-500-29/32-14/23 по ГОСТ 25336;
— каплеуловителя с отводом типа КО-4 по ГОСТ 25336;
— холодильника спирального с внутренним охлаждением ХСВ или прямого ХПТ с длиной кожуха 400 мм по ГОСТ 25336;
Виды кислот и способы их получения
В химии неорганические соединения делятся на простые и сложные вещества. Простые состоят из атомов одного химического элемента, сложные — из нескольких. Сложные неорганические вещества делятся на пять основных классов: кислоты, основания, амфотерные гидроксиды, оксиды, соли.
Разберёмся с первым классом из списка — кислотами.
Что такое кислота — определение в химии
Кислоты — это сложные вещества, которые состоят из атомов водорода и кислотных остатков.
A c — кислотный остаток;
x — число атомов водорода;
n — степень окисления кислотного остатка.
В химических реакциях активный атом водорода может замещаться на атом металла, в результате чего получается соль. Кислотный остаток — это часть молекулы кислоты без атомов водорода. Валентность кислотного остатка равна числу связанных с ним атомов водорода.
Виды кислот и их классификация, какие бывают (примеры)
Существуют несколько классификаций кислот. Разберёмся с основной классификацией, созданной по формальным признакам: содержанию кислорода, растворимости и так далее.
По содержанию кислорода
Кислоты могут делиться на кислородосодержащие и бескислородные.
Кислородсодержащие получаются при воздействии воды на кислотные оксиды — ангидриды.
Их название в корне содержит название элемента, входящего в состав ангидрида. Примеры:
Номенклатура выглядит следующим образом. В случае, если элементу соответствуют несколько кислот, для названия кислоты с большей валентностью такого элемента употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Например, серная ( H 2 S O 4 ) и сернистая кислота ( H 2 S O 3 ).
Бескислородные представляют собой растворы некоторых газов в воде. Названия бескислородных кислот составляют по принципу: элемент + водородная кислота.
Важно, что газ и раствор газа имеют различные свойства. Например, хлороводород и соляная кислота.
Газ хлороводород можно получить из водорода и хлора. Уравнение:
H 2 + C l 2 → 2 H C l
В сухом состоянии такой газ не проявляет кислотных свойств. При перевозке в тех же металлических ёмкостях не происходит никаких реакций. Но, если хлороводород растворить в воде, получается раствор, который называют соляной кислотой. Она обладает сильными кислотными свойствами и опасна при реагировании с металлом.
По растворимости в воде
Кислоты делят на растворимые и нерастворимые. Большинство кислот растворимы. Нерастворимые — кремниевая H 2 S i O 3 и все органические карбоновые кислоты, содержащие десять атомов углерода и больше.
По летучести
Летучие кислоты — это химические соединения, которые быстро испаряются при нормальных условиях, то есть молекулы легко переходят в газовую фазу. В их список входят, к примеру, органические соединения, которые образуются в человеческом организме в результате процесса пищеварения, болезней или метаболизма.
Список летучих кислот:
Нелетучими являются все остальные. Они стабильны в водных растворах.
По силе (степени диссоциации)
Кислоты также можно разделить на сильные и слабые. Если в водном растворе кислота полностью распадается на ионы (диссоциирует), то она является сильной. Слабые кислоты не распадаются на ионы полностью, обычно их диссоциация протекает в незначительной степени.
Как определить силу кислоты, то есть степень диссоциации? Можно использовать лёгкий приём: вычесть из числа атомов O число атомов H. Если в ответе получается число меньше 2 — слабая. Больше или равно — сильная.
Степень диссициации можно также установить экспериментальным путем посредством измерения проводимости растворов. Разбавленные растворы сильных кислот хорошо проводят электрический ток, растворы слабых кислот — плохо.
Характерные химические и физические свойства
Химические свойства
Взаимодействие с основными оксидами. Образуются соль и вода:
C a O + 2 H C l → C a C l 2 + H 2 O
Взаимодействие с амфотерными оксидами. Образуются соль и вода:
Z n O + 2 H N O 3 → Z n ( N O 3 ) 2 + H 2 O
Взаимодействие со щелочами. Образуются соль и вода (реакция нейтрализации):
N a O H + H C l → N a C l + H 2 O
Взаимодействие с солями. Реакция протекает, если выпадает осадок или выделяется газ:
B a C l 2 + H 2 S O 4 → B a S O 4 ↓ + H C l ↑
Сильные кислоты вытесняют более слабые из их солей:
K 3 P O 4 + 3 H C l → 3 K C l + H 3 P O 4
Также металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (если соль, которая образуется в итоге, растворима):
M g + 2 H C l → M g C l 2 + H 2 ↑
Однако! С азотной и концентрированной серной кислотами реакция идёт иначе:
M g + 2 H 2 S O 4 → M g S O 4 + S O 2 ↑ + 2 H 2
Физические свойства
Получение и применение кислот
Кислоты можно получить несколькими методами.
Взаимодействие кислотного оксида с водой:
H 2 O + S O 3 → H 2 S O 4
Взаимодействие водорода и неметалла:
H 2 + C l 2 → 2 H C l
Вытеснение слабой кислоты из солей более сильной кислотой:
3 H 2 S O 4 + 2 K 3 P O 4 → 3 K 2 S O 4 + H 3 P O 4
Кислоты находят широкое применение в различных сферах. К примеру, серная используется для производства лакокрасочных материалов и минеральных удобрений. Борная является медицинским антисептиком. Уксусную и лимонную добавляют при приготовлении выпечки, а аскорбиновую применяют при лечении простудных заболеваний.