Что значит лечить не болезнь а больного
Уважаемые коллеги!
В наше время становится все больше факторов, прямо или косвенно влияющих на здоровье. Причем один и тот же фактор на каждого человека оказывает разное воздействие. Кто-то радуется бодрящему морозу, яркому
В наше время становится все больше факторов, прямо или косвенно влияющих на здоровье. Причем один и тот же фактор на каждого человека оказывает разное воздействие. Кто-то радуется бодрящему морозу, яркому солнечному свету, цветению трав и деревьев, общению с домашними животными, а кто-то в это время сильно страдает от слезотечения, кожных реакций различной степени тяжести. Иногда дело заканчивается вызовом неотложки и госпитализацией в стационар. Виновник всех бед — аллергия. Именно этому заболеванию посвящен новый номер журнала, тем более что пик обострения аллергических заболеваний приходится на весенне-летний период.
Это достаточно серьезная и в то же время «всевозрастная» проблема, часто затрагивающая даже новорожденных малышей. Иногда аллергические проявления, напротив, впервые возникают в зрелом возрасте, у человека, ранее представления не имевшего об этом заболевании. Многие специалисты склонны объяснять такие проявления вредным влиянием городской среды, появлением новых продуктов, накоплением аллергенов в человеческом организме, профессиональной вредностью и т. д. Однозначного мнения на этот счет до сих пор не существует, так же как во многих случаях не существует препарата, способного полностью излечить от аллергии. Решением всех подобных вопросов на протяжении ряда лет занимаются и генетики, и врачи, и фармацевты, и диетологи.
Известно, что «мы есть то, что мы едим», но не всегда только коррекция диеты позволяет достичь полного излечения. Начинать плановое лечение, безусловно, нужно с определения аллергена, вызвавшего реакцию, и устранения, по возможности, контакта с ним. И только потом следует вносить коррективы в рацион питания и назначать лечение. Совсем другая тактика разработана для экстренного купирования аллергических реакций. Обо всем этом можно прочитать на страницах лежащего перед вами номера.
Сейчас создаются и разрабатываются много новых препаратов, в том числе комбинированных, обладающих более сильным эффектом, чем лекарственные средства предыдущих генераций. Но распространенность аллергических заболеваний и в нашей стране, и во всем мире растет, все больше появляется сложных, резистентных к лечению форм. Еще Парацельс утверждал: «Болезнь не может приспосабливаться к знанию врача». Поэтому приспосабливаться приходится врачу. Но лечить нужно не болезнь, а больного. Помните всегда об этом.
Полезного вам чтения и профессионального лечения, дорогие коллеги!
Ваш главный редактор, Софья Камзолова
Журнал «ПАРТНЕР»
Лечить больного или болезнь?
Многие читатели в своих письмах «жалуются» на то, что немецкие врачи, по их мнению, прежде всего ориентируются на данные аппаратного обследования. О разных подходах к лечению болезни или больного и о роли аппаратных средств диагностики рассказывает доктор Рудольф Воробьёв.
Д-р Рудольф Воробьёв (Карлсруэ)
Среди российских медиков, да и широкой публики, особенно в советское время, этот призыв Мудрова был весьма популярен. В советской медицине в результате извращения физиологического учения И. Павлова под «теорию» Мудрова была подведена «научная» база. И здесь, в Германии, бывшие российские медики исповедуют лозунг «лечить больного, а не болезнь». Этот постулат относится к одной из актуальных проблем медицины – взаимосвязи общего и местного в патологии. Верное решение проблемы во многом определяет стратегию и тактику лечения.
Каково должно быть отношение врача к призыву Мудрова, если исходить из позиций современной медицины? Ответ на этот вопрос станет ясен при дальнейшем изложении.
В самом деле, достаточно удалить воспаленный аппендикс или больной зуб, чтобы вернуть пациенту радость бытия, при этом лечить весь организм вовсе не требуется.
Так как патологический процесс протекает в едином организме, то заболевания некоторых органов способствуют поражению других органов. Ангина, например, осложняется (не всегда) ревматизмом – поражением суставов и сердца, а также нефритом, который может возникнуть и после скарлатины. Холецистит порой вовлекает в патологический процесс поджелудочную железу. Однако уши, глаза, прямая кишка и другие органы и ткани при этом не поражаются и поэтому в лечении не нуждаются.

Вопреки Мудрову, считавшему, будто любой патологический процесс распространяется по всему организму, в действительности в нормальных условиях всё происходит наоборот. При возникновении патологического очага в организме мобилизуются соответствующие механизмы – иммунные и др., ликвидирующие болезненный очаг и компенсирующие нанесенный организму урон – анатомический и функциональный (физиологический). Например, при кровотечении активизируется кроветворение и в результате сложных химических реакций образуются тромбы, закупоривающие кровоточащий сосуд. Образовавшийся дефект ткани усиливает регенерацию путем деления клеток и дефект ликвидируется. Однако клетки нервной системы, в том числе головного мозга, и сердечной мышцы (миокарда) делением не размножаются. Но это не означает, что нервная система и сердце не способны восстанавливать свои функции при гибели нервных клеток или клеток миокарда. Регенерирует их внутриклеточная структура.

Против официально принятой в СССР формулировки «лечить больного, а не болезнь», которой медики со студенческой скамьи обязаны были следовать, осмелился выступить академик медицины И.Кассирский, настаивавший на лечении диагностированной у конкретного больного определенной болезни, но отнюдь не всего организма.

Отношение больного к болезни во многом определяется не только и даже не столько тяжестью заболевания, сколько характером больного, его мнительностью и др.
Успешность врачевания обусловлена в значительной мере личностью врача: уровнем его интеллекта, объемом специальных знаний, врачебным талантом, профессионализмом, умением подмечать малейшие подробности во время собирания анамнеза (при опросе) больного и в клинической картине с учетом лабораторных данных, физического состояния и психического статуса пациента.
Врач должен положительно влиять на настроение больного, на что обратил внимание академик В.Бехтерев: «Если больному после разговора с врачом не становится легче, то это не врач».
Конечно, одного только обаяния врача для успешного врачевания недостаточно.
Прав Мечников: «. врач, преисполненный величайшей симпатией к больным, но без необходимых знаний, может принести им огромное зло».
К сожалению, в последние годы наблюдается дегуманизация медицины. Кассирский, полемизируя с теми, кто преувеличивает значение техники для медицины, отмечал, что напрасно воинствующие «инструменталисты» иронически относятся к понятиям «интуиция» и «врачебный опыт», рекомендуя «кибернизировать» медицину. Ибо даже самая совершенная машина никогда не заменит головной мозг человека в умственных операциях, ведь компьютер – творение человеческого интеллекта.
Внедрение в медицину технических средств, безусловно помогающих врачу диагностировать болезнь, сократило общение врача с пациентом, воздвигнув «берлинскую стену» между ними. Врачу не остается времени тщательно клинически обследовать больного, благотворно воздействовать на его психику. И не машина оказывает психологическое влияние на больного, а врач!
Техника, которой насыщена современная медицина: томографы, компьютеры, электронные микроскопы и др. – предназначена лишь помогать врачу обследовать больного, но не подменять врача. Правда, эта истина не всеми осознается. Техника повышает возможности врача диагностировать заболевание, но порою и даже часто превращается в свою противоположность, если врач, уповая на многочисленные обследования пациента, иногда ненужные, а порой вредные, перестает активно мыслить.
Врач, диагностировав болезнь, лечит ее, учитывая, повторяю, индивидуальные особенности больного. Саркисов, много внимания уделявший изложенной в статье проблеме, совершенно обоснованно утверждает: необходимо «лечить данную болезнь у. конкретного больного» и предлагает положить это правило «в основу воспитания современного медицинского работника».
Не лечите меня по стандарту
Михаил Перельман: Действительно, сегодня врачи активно вовлечены в процесс стандартизации. Еще в 1998 году Минздрав России и Федеральный фонд обязательного медицинского страхования издали приказ об организации работ по стандартизации в здравоохранении. Она необходима в сфере лекарственного обеспечения, требований к условиям оказания медицинской помощи и т.д.
Подобная стандартизация понятна и оправданна. А в клинической медицине, во врачевании?
Об этом, похоже, начисто забыли. Достаточно вспомнить о приеме студентов в медицинские вузы по итогам ЕГЭ и без собеседования!
Что же можно стандартизировать в клинической медицине?
Но эти факторы стандартизировать крайне сложно.
Михаил Перельман: Сложно. И даже, может быть, невозможно. Поэтому основные направления стандартизации в медицине должны быть ограничены метрологией, терминологией, условными обозначениями, типовой документацией, техническим оснащением, фармакологическими средствами, оборудованием, принципами безопасности труда. Все протоколы ведения больных, которые разрабатываются и совершенствуются медицинским сообществом, имеют рекомендательный характер и должны быть лишь ориентировочной основой действий врача. Главное: лечить не болезнь, а больного. Все люди по своей генетической структуре разные. Одинаковые только однояйцевые близнецы.
Значит, положения о стандартизации профилактических мероприятий у здоровых и о стандартизации лечения больных неправомерны?
Михаил Перельман: Решение исключительно на совести врача. Ведь пациент, особенно онкологического профиля, в условиях платной медицины беззащитен, а оценить правомерность действий врача в подобных ситуациях не может никакая экспертиза.
Казалось бы, говорим об очевидном. Однако в официальной концепции развития здравоохранения России до 2020 года в разделе «Стандартизация медицинской помощи» сказано, что стандарты «содержат сведения по профилактике, диагностике, лечению конкретных заболеваний и синдромов».
Михаил Перельман: Еще и еще раз повторюсь: лечить необходимо не заболевания и синдромы, а больных людей! И поскольку все эти люди разные одинаково лечить их нельзя: нужен индивидуальный, персональный подход. Стандарты для лечения болезней с этих позиций неправомерны! И врачи это понимают. Мои бывшие шефы, всемирно известные хирурги Евгений Николаевич Мешалкин и Борис Васильевич Петровский, не признавали стандартизации лечения. Борис Васильевич говорил: «Если я заболею, не лечите меня по стандарту». А Евгений Николаевич был более резок: «Стандарты нужны врачам, которые не хотят думать или которым нечем думать».
На 1-м Национальном съезде врачей России в октябре этого года отмечено, что стандарты предназначены в первую очередь для организаторов здравоохранения, а не для врачей. Стандарты необходимы для выравнивания организационных, материально-технических и кадровых условий оказания медицинской помощи стандартного качества в каждом регионе страны. Стандартизация здравоохранения и стандартизация медицины совсем не одно и то же. Вспоминаю эпизод семидесятых годов прошлого столетия. Мы в Институте хирургии обратились к директору Борису Васильевичу Петровскому с просьбой помочь в диагнозе у одного пациента.
— Думаем, что да. Ведь вы очень опытный врач, академик и даже министр здравоохранения Советского Союза.
ВОЗ, которая всегда отличалась тенденцией к стандартизации режимов лечения, стала менять свои позиции. Эксперт ВОЗ Карин Вейер отметила, что «мы вступаем в новую эру, в которой не может быть одного размера для всех». В США для лечения одной и той же болезни могут быть использованы до 20 разных протоколов в зависимости от учреждения, страховой компании.
Персональная медицина не становится всеобщей из-за высокой цены диагностических технологий?
Михаил Перельман: Пока да. Но их стоимость по мере совершенствования, востребованности снижается. Персональная медицина за счет рационального подбора лекарств, эффективности станет дешевле нынешней. И врачам надо постепенно менять свой менталитет, переходить именно к такой медицине.
Лечить не болезнь, а больного
Широко известный принцип, что «лечить нужно не болезнь, а больного», был провозглашен еще знаменитым врачевателем древности Гиппократом.
Однако многим из нас довелось убедиться на собственном печальном опыте, что современная медицина ориентирована на лечение «отдельных симптомов» у некоего среднестатистического человека. И все же «свет в конце тоннеля» виден: в нашу «постгеномную эру» благодаря новейшим достижениям молекулярной биологии появилось и находит все более широкое распространение понятие «персонализированная медицина». Это дает надежду, что индивидуальный подход к медицинской помощи наконец станет реальностью
Даже древние целители, зачастую имевшие смутные представления о деятельности и строении человеческого организма, считали важным дифференцированно подходить к лечению своих пациентов. Занимаясь, пусть и не всегда успешно, восстановлением «природной гармонии» или «баланса телесных соков» больного, они старались учитывать его физическую конституцию, образ жизни, характер питания и даже особенности места проживания.
Позже, с развитием так называемой классической медицины и появлением ряда новых естественнонаучных дисциплин, таких как анатомия, физиология, биохимия и фармакология, врачи научились справляться с массой недугов, считавшихся ранее неизлечимыми. Но при этом медицина стала во многом «обезличенной», и место реального страдающего человека занял обобщенный статистический образ. Лишь в некоторых случаях (например, при переливании крови или трансплантации тканей) специалисты были вынуждены в обязательном порядке учитывать индивидуальные особенности организма больного.
Но развитие, как известно, всегда идет по спирали. Поэтому неудивительно, что, начиная с конца прошлого века, в специализированной литературе появился и стал все чаще использоваться термин индивидуализированная (персонализированная) медицина. Речь идет о новой модели организации медицинской помощи, которая позволит выбирать диагностические, лечебные и профилактические средства, оптимальные для конкретного человека с учетом его генетических, физиологических и биохимических особенностей. Конечная цель такой медицины – сделать профилактику и лечение болезней при наименьших затратах как можно более эффективными и безопасными.
Молекулярная биология как точка опоры
Фундаментом для развития персонализированной медицины стали выдающиеся успехи, достигнутые в молекулярной биологии за последние десятилетия.
Отправной его точкой стал знаменитый международный проект «Геном человека», стартовавший в 1990 г. Его цель состояла в расшифровке полной нуклеотидной последовательности ДНК и установления точной локализации отдельных генов в нашем геноме. Результаты этого проекта, выразившиеся, в том числе, и в бурном развитии технологий массового секвенирования ДНК, позволили медицинской генетике вплотную приблизиться к клинической практике.
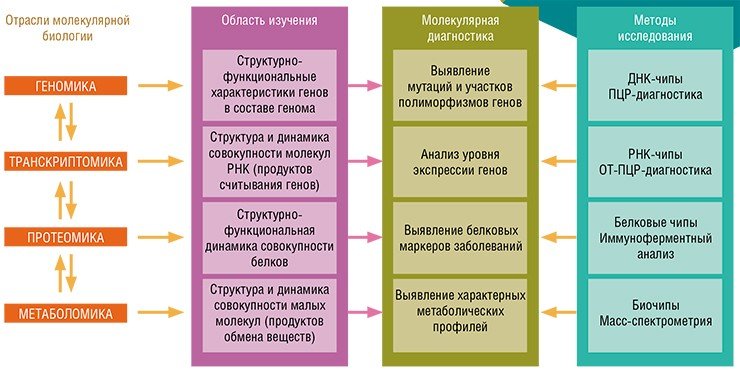
Дальнейшее развитие персонализированной медицины тесно связано с обособлением новых биологических дисциплин, занимающихся изучением различных уровней реализации информации, заключенной в геноме: транскриптома – совокупности продуктов транскрипции (считывания) генов; протеома – совокупности всех белковых молекул и, наконец, метаболома – совокупность относительно небольших молекул-метаболитов, конечных продуктов обмена веществ.
Фармацевтические приложения вышеперечисленных дисциплин – фармакогенетика, фармакогеномика и фармакопротеомика – стали важнейшими основами персонализированной медицины. Разница между фармакогенетикой и фармакогеномикой заключается в том, что первая дисциплина изучает изменчивость пациентов по их реакции на лекарства, соответственно, ее целью является подбор адекватных препаратов для больных определенного генетического профиля; фармакогеномика же занимается разработкой новых лекарственных средств на основе исследований специфического воздействия различных соединений на работу генов на уровне целостного генома.
Почему эти дисциплины так важны? Дело в том, что в наши дни, когда лекарственные препараты назначаются без учета индивидуальных особенностей реакции организма, у 20–75% пациентов проявляется неадекватная реакция на фармакотерапию либо нежелательные побочные действия лекарства. По данным Американской медицинской ассоциации, в 2004 г. в США такие побочные реакции послужили причиной госпитализации 2 млн человек и смерти более 100 тыс. (Зырянов и др., 2008).
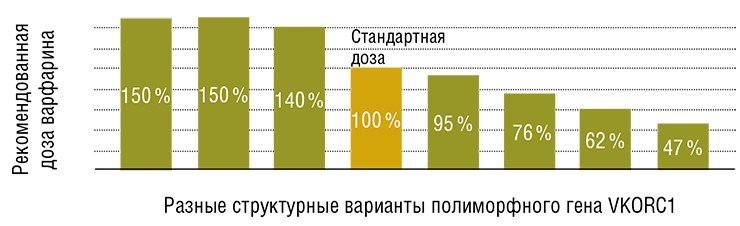
Причина подобных явлений в том, что лекарства метаболизируются у разных людей по-разному. Например, скорость выведения их из организма может отличаться в десятки раз! Однако, зная индивидуальные особенности генотипа и процессов «развертывания» генетической информации на уровне целостного организма, можно разработать прогностические тесты, позволяющие еще до начала медикаментозного лечения определить его эффективность и вероятность развития побочной реакции у конкретного пациента.
Выбор оптимального метода фармакотерапии на самом раннем этапе лечения способствует и более четкому соблюдению режима пациентом, и, что немаловажно, сокращению медицинских расходов. Признание факта существования межличностных различий в ответе на фармацевтический препарат – важный шаг к персонализации и оптимизации терапии.
«Технологический» диагноз
Важнейшей основой персонализированной медицины является молекулярная диагностика. Она не отвергает классические методы постановки диагноза, такие как сбор анамнеза, осмотр больного, клиническое обследование, но основной упор при этом делается на высокотехнологичный анализ биологических макромолекул (ДНК, РНК и белки).
Можно выделить несколько аспектов молекулярной диагностики в приложении к персонализированной медицине: раннее выявление болезни; подбор адекватного лечения безопасным и эффективным препаратом; интеграция диагностики и терапии; мониторинг лечения и определение прогноза.
Молекулярная диагностика широко используется для генетического тестирования, а также в генетическом скрининге больших популяций. Например, уже сейчас в роддомах проводится массовое генетическое обследование новорожденных с целью выявления наследственных заболеваний. Классический пример подобных заболеваний – фенилкетонурия, которой в нашей стране болеет один ребенок из 8—10 тыс. У детей с фенилкетонурией в будущем развивается умственная отсталость, но если поставить диагноз своевременно, то для предотвращения развития патологии достаточно будет исключить из рациона ребенка продукты, содержащие аминокислоту фенилаланин.
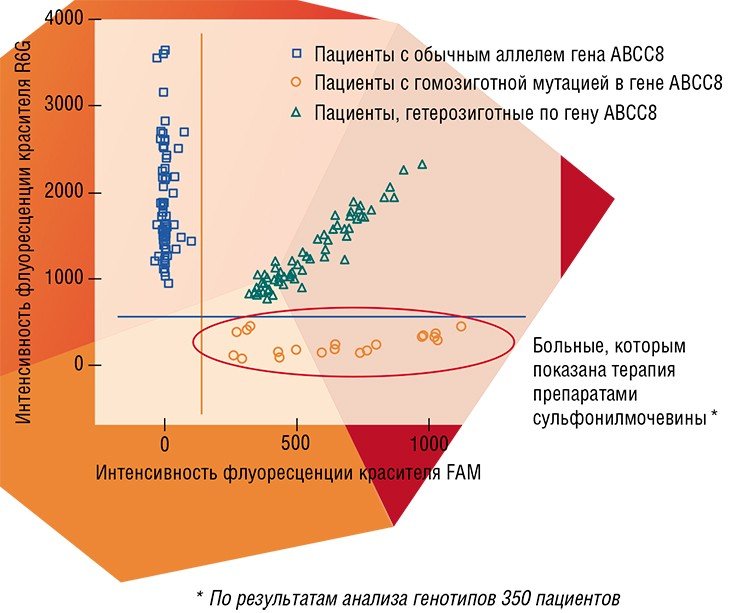
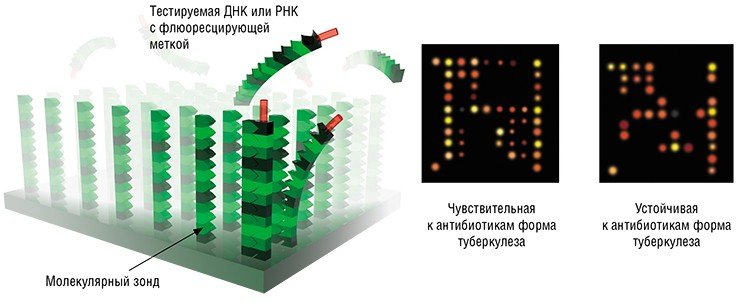
Методы молекулярной диагностики основаны на использовании биомаркеров – выявленных с помошью специальных исследований определенных биологических молекул, указывающих на то или иное состояние систем и тканей организма. К биомаркерам относятся и участки генов, ответственных за тот или иной признак организма, например, за предрасположенность к определенной болезни. И в этом смысле на сегодня важнейшими технологиями в приложении к персонализированной медицине являются генотипирование полиморфизма (вариабельности) генов по единичным нуклеотидам, а также биологические микрочипы, с помощью которых можно обнаружить в клиническом образце протяженные нуклеотидные фрагменты ДНК и РНК.
Биочипы — миниатюрные приборы, предназначенные для одновременной регистрации множества взаимодействий между различными молекулами. В основе этой технологии лежит комплементарность молекул, т. е. способность связываться по принципу «замок—ключ». На пластинке биочипа в строгом порядке закреплено множество так называемых молекулярных зондов, которые избирательно реагируют с определенными участками молекул-мишеней из клинического образца, взятого у пациента.
Биочиповая технология неизмеримо расширила диагностические возможности персонализированной медицины: на ее основе можно создавать портативные устройства для молекулярной диагностики, при этом один биочип может одновременно нести множество самых разнообразных зондов на различные молекулы-мишени. Эта технология также позволяет значительно ускорить процесс разработки новых «персонализированных» лекарственных средств.
Терапия рака
На сегодня лидером по внедрению элементов персонализированной медицины в медицинскую практику является онкология. При оперативном вмешательстве или биопсии в ткани опухоли сегодня можно определить ряд онкологических маркеров, чтобы выработать стратегию лечения для конкретного пациента. Специфические мутации определенных генов, с которыми связана тяжесть течения заболевания и прогноз лечения, уже обнаружены для рака молочной железы, меланомы, некоторых форм рака легкого и рака толстой кишки.
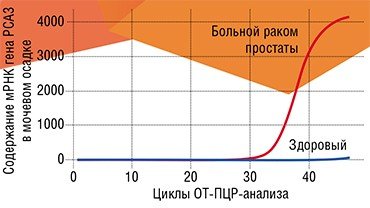
Яркий пример таких биомаркеров – белок-рецептор так называемого эпидермального фактора роста 2-го типа (HER2). В каждом пятом случае рака молочной железы и в 15 % случаев рака желудка наблюдается повышенный синтез этого белка, и в этих случаях болезнь принимает агрессивную форму. Сегодня с помощью специального теста можно вовремя обнаружить такую особенность пациента и назначить специфический блокатор (Yamauchi et al., 2001).
Еще один подобный пример – мутация в гене BRAF, участвующем в регуляции процесса деления клеток. Эта мутация встречается примерно у половины больных метастатической меланомой. Для этого случая также разработан целевой препарат, позволяющий уменьшить тяжесть протекания заболевания (Flaherty, 2010).
Для лечения некоторых форм рака принято использовать интерферон, но такая терапия оказывается успешной только у 20–30% больных, у остальных же вызывает тяжелые побочные эффекты. Молекулярная диагностика с помощью биочипа производства фирмы Hoffmann-LaRoche дает возможность выявить пациентов, чувствительных к этому препарату. Этим больным можно назначать лечение интерфероном на ранних стадиях заболевания, тогда как прежде применение интерферона допускалось лишь в крайних, запущенных случаях болезни (Jain, 2002).

Известно, что у разных пациентов сильно варьирует и реакция на химиотерапию, что может быть обусловлено генетическими различиями метаболизма. Соответствующее тестирование пациентов могло бы помочь избежать тяжелого и неэффективного лечения.
К сожалению, в России, особенно в отдаленных регионах, на сегодняшний день не имеется достаточного числа клинических лабораторий, в которых можно проводить тестирование опухолевого материала от каждого больного. И в этом смысле достижения фармакогеномики в нашей стране практически не используются, хотя, согласно ожиданиям, в течение ближайшего десятилетия появятся молекулярно-диагностические технологии, которые будут учитывать специфику всех применяемых онкологических препаратов.
Для сердца и сосудов
В последние годы для решения этой проблемы также начинают привлекать возможности персонализированной медицины. Например, было показано, что на эффективность препарата фосиноприла – ингибитора ангиотензинконвертирующего фермента (АКФ) – влияет полиморфизм гена, кодирующего этот фермент (Stavroulakis, Makris, 2000). Компания Sequenom выпускает тест для выявления пациентов, которых следует в первую очередь лечить препаратами группы антагонистов АКФ. Такое тестирование позволяет уменьшить число лекарственных препаратов, необходимых для адекватного лечения.
Всем также известно, что одним из основных факторов развития стенокардии – формы ишемической болезни сердца, является повышенный уровень «плохого» холестерина в крови. Для его снижения используют препараты группы статинов (симвастатин, аторвастатин и др.). В 2002 г. компания Genaissance закончила масштабное клиническое исследование, цель которого заключалась в поиске специфических генетических маркеров, связанных с эффективностью дейcтвия этих препаратов. В результате удалось выявить около сотни генов, которые могут быть связаны с «ответом» пациента на статины (Jain, 2002).
Имеется еще немало примеров, демонстрирующих применение передовых геномных технологий для индивидуализации лечения больных. Предполагается, что в ближайшее время персонализированная медицина будет активно развиваться в таких областях, как кардиология, иммунология и заболевания центральной нервной системы. В более отдаленной перспективе ее возможности будут использоваться при лечении метаболических расстройств и даже респираторных заболеваний.
Трудности роста
Работа над конкретными технологическими решениями в области молекулярной диагностики идет постоянно. Однако сегодня мы явно недооцениваем сложность превращения громадных объемов данных, полученных в научных исследованиях, в новые клинически ценные продукты.
Как это ни печально, но большинство открытых за последнее десятилетие биомаркеров в настоящее время нельзя использовать для улучшения уже существующих клинических тестов. Дело в том, что потенциально значимый биомаркер должен быть воспроизводимым, чувствительным и специфичным. Поэтому сначала его требуется валидировать, т. е. подтвердить на сотнях клинических образцов тканей, что подразумевает существование больших коллекций образцов от пациентов и соответствующих баз данных. Такой же длительной и дорогостоящей апробации требует и разработанное для определения маркера технологическое решение.
Поэтому неудивительно, что большинство открытых биомаркеров так и остаются лишь упоминанием в научных публикациях. Например, простой поиск по ключевым словам «cancer marker clinical validation» (клиническая валидация опухолевых маркеров) в базе данных Medline выдает 1592 результата, тогда как по ключевым словам «new cancer marker» (новые опухолевые маркеры) – почти 30 тысяч!
Во многом именно эта «болевая» точка замедляет развитие современной персонализированной медицины в России, и именно здесь должны быть приложены значительные усилия для преодоления имеющихся проблем.
До сих пор не вполне ясен и экономический аспект внедрения новых медицинских технологий в практическую медицину. Маркетологи испытывают затруднения с оценкой стоимости такого лечения, но есть все основания считать, что массовое использование технологий персонализированной медицины со временем должно окупиться за счет повышения эффективности диагностики и, в конечном итоге, снижения сроков лечения и реабилитации больного.
Что же врачи и их пациенты могут ждать от персонализированной медицины в будущем?
На рынке будут появляться новые портативные диагностические устройства. Дальнейшее развитие информационной сферы обеспечит доступ пациентов к своим медицинским данным в электронном виде, включая генетический профиль.
Благодаря появлению возможности определять генетическую предрасположенности к тем или иным болезням, врачи будут разрабатывать комплекс индивидуальных профилактических мер, а в случае наступления заболевания – назначать лечение в соответствии с генетической конституцией больного, включая конкретно для него изготовленное лекарство.
Но это, конечно, идеальная ситуация. Что касается нашей страны, то развитие в России персонализированной медицины связано, в первую очередь, с активизацией фармакогеномных исследований социально значимых заболеваний человека, таких как рак и сердечно-сосудистые заболевания, лекарственная терапия которых особенно сложна и дорогостояща. По мнению специалистов, необходимо инициировать создание электронных экспертных систем и банков биоматериалов, а также проведение продолжительных эпидемиологических проектов, которые на сегодня в России полностью отсутствуют (Баранов, 2011).
Федорова О. С., Коваль В. В. Протемика – высокотехнологичная рыбалка // НАУКА из первых рук. 2010. №2 (32). С. 84—90.
Коптюг А. В., Мамонтов Е. В., Суховей Ю. Г. На пути к персонализированной медицине // НАУКА из первых рук. 2011. №2 (38). С. 90—97.
Коптюг А. В., Мамонтов Е. В., Суховей Ю. Г. На пути к персонализированной медицине. Динамическая модель развития опухоли // НАУКА из первых рук. 2011. № 6 (42). С. 44—51.
Лифшиц Г. И., Новикова Я. В. Терапия: персональная доза // НАУКА из первых рук, 2010. №2 (32). С. 91—94.
Синяков А. Н. Диагноз – дело техники! // НАУКА из первых рук. 2007. №5 (17). С. 40—49.
Черноносов А. А. Красноречивые метаболиты // НАУКА из первых рук. 2010. №2 (32). С. 84—90.
Jain K. K. Personalized Medicine. Basel: Jain PharmaBiotech Publications, 2003.
Jain K. K. Textbook of Personalized Medicine. New York: Springer, 2009. 419 p.