Что вызывают возникающие бактериальные метаболиты
Метаболиты кишечных бактерий лактат и пируват имеют большое влияние на иммунитет
Небольшие метаболиты нормальных кишечных бактерий имеют большое влияние на кишечный иммунный ответ
Бактериальные метаболиты пируват и лактат оказывают большое влияние на иммунитет стимулируя кишечные макрофаги
В течение по крайней мере десятилетия исследователи знали, что нормальные бактерии в кишечнике могут стимулировать кишечные иммунные клетки, чтобы те расширяли щупальцеобразные структуры, известные как дендриты, для “захвата” антигенов, вызывая как немедленные, так и долгосрочные иммунные реакции. Что было менее ясно, так это то, как бактерии активируют этот процесс. Теперь исследовательская группа во главе с японским Университетом Осаки (Osaka University) обнаружила, что молекулы, ответственные за это, скрываются на виду…
Дендритная протрузия клеток кишечника бактериальными метаболитами
Затем, исследователи определили GPR31, протеин находящийся на поверхности небольших кишечных макрофагов, как специфическое приемное устройство для 2 метаболитов. У мышей без GPR31 после введения пирувата или лактата наблюдалось снижение дендритной протрузии клетками CX3CR1 + и, как следствие, снижение продукции антител после инфицирования непатогенным штаммом сальмонеллы. Однако самое важное открытие было еще впереди.
Корреспондирующий автор Киоси Такэда (Kiyoshi Takeda) объясняет, что исследование имеет несколько клинических применений. “Поскольку эти метаболиты усиливают иммунный ответ, их можно использовать для повышения эффективности пероральных вакцин, в то время как белок GPR31 является перспективной мишенью для терапии, направленной на устранение кишечных патогенов. Из-за этого мы ожидаем, что молочная кислота, пировиноградная кислота и GPR31 будут изучены в ближайшем будущем в качестве новых мишеней для активации иммунитета.”
Рисунок 1: Роль бактериальных метаболитов, лактата и пирувата в кишечном иммунном ответе.
Кишечная микробиота, такая как лактобациллы, производит лактат и пируват. Эти метаболиты стимулируют кишечные макрофаги через рецептор GPR31, позволяя макрофагам делать выступающими трансэпителиальные дендриты и эффективно поглощать патогенные бактерии в кишечнике. Соответственно, лактат и пируват вызывают усиленные иммунные реакции на патогенные бактерии и повышенную устойчивость к инфекции.
Рисунок 2: Дендритные протрузии кишечных макрофагов лактатом и пируватом.
Мышам перорально вводили лактат или пируват в течение трех недель. Показаны 3D изображения мелких кишечных ворсинок. Макрофаги помечены зеленым цветом, а их трансэпителиальной дендриты обозначены стрелками. Введение лактата или пирувата резко увеличило количество дендритов макрофагов у мышей дикого типа, но не у мышей с дефицитом GPR31.
Источник:
Статья «GPR31-зависимая дендритная протрузия клеток кишечника CX3CR1 + бактериальными метаболитами” опубликована в Nature: GPR31-dependent dendrite protrusion of intestinal CX3CR1+ cells by bacterial metabolites
Микробиота кишечника: ключевой регулятор метаболических заболеваний
Кишечная микробиота и нарушение обмена веществ
Микробиота кишечника: ключевой регулятор метаболических заболеваний
Резюме
Распространенность ожирения и диабета 2 типа, двух тесно связанных метаболических нарушений, растет во всем мире. За последнее десятилетие связь между этими расстройствами и микробиотой кишечника стала основным направлением биомедицинских исследований, при этом недавние исследования продемонстрировали фундаментальную роль кишечной микробиоты в регуляции и патогенезе метаболических нарушений. Однако из-за сложности сообщества микробиоты основные молекулярные механизмы, с помощью которых микробиота кишечника связана с метаболическими нарушениями, остаются плохо изученными. В этом обзоре мы обобщаем недавние исследования, в которых изучается роль микробиоты как у людей, так и у животных моделей болезней, и обсуждаем соответствующие терапевтические цели для будущих исследований. [Отчеты BMB 2016; 49 (10): 536-541]
Микробиота слизистой оболочки кишечника
Кишечник хозяина уникален тем, что он постоянно подвергается воздействию множества антигенов из ежедневного приема пищи и экзогенных бактерий. Резидентная микробиота кишечника содержит ряд компонентов, способных активировать ответы как врожденного, так и адаптивного иммунитета (3, 9). Например, большинство кишечных бактерий являются грамотрицательными анаэробами, снабженными разнообразными агентами, такими как липополисахариды ( ЛПС ) и жгутики, что позволяет передавать врожденную сигнализацию кишечным эпителиальным клеткам через toll-подобные рецепторы ( TLR ) (10). Сегментированные нитчатые бактерии ( SFB ), внедренные в подвздошную кишку, также могут стимулировать адаптивные ответы Т-хелперов 17 ( TH17 ) и индуцировать выработку антител к иммуноглобулину A ( IgA ) слизистой оболочки (11). Кроме того, бутират, полученный из комменсальных микробов, связан с дифференцировкой регуляторных T (Treg)-клеток в толстой кишке (12).
Микробиота кишечника и нарушения обмена веществ
Чтобы решить эту проблему, с тех пор были приняты эксперименты по трансплантации микробиоты. Первоначальное исследование, проведенное Gordon et al., показало, что конвенционализация мышей без микробов с нормальной микробиотой приводила к увеличению содержания жира в организме и резистентности к инсулину в течение 14 дней, несмотря на снижение потребления пищи (19). Это исследование предоставило первое механистическое доказательство того, что кишечные микробы могут увеличить способность хозяина накапливать жировые отложения. Кроме того, у мышей без микробов, получавших кишечные микробы от тучного донора-близнеца, наблюдалось увеличение общей массы тела и жира, а также метаболических фенотипов, связанных с ожирением, по сравнению с теми, кто получал микробиоту худого близнеца (20). Интересно, что микробиота кишечника худой мыши могла вторгаться в микробиоту тучной мыши и обеспечивать защиту от увеличения веса, но это влияние зависело от диеты. Другие исследования показали, что безмикробные мыши, которым пересажена микробиота, связанная с ожирением, набирали вес, но не до чрезмерного ожирения (21). Таким образом, необходимо учитывать роль диеты и других факторов.
Диета изменяет микробиоту кишечника
Диета является одним из основных факторов ожирения, а также помогает формировать микробиоту кишечника. Исследования на людях за последнее десятилетие показали, что кишечная микробиота быстро реагирует на большие изменения в рационе; во многих случаях состав и функции кишечной микробиоты меняются в течение 1-2 дней (22, 23). Несмотря на такую стремительную динамику, долгосрочные диетические привычки по-прежнему играют решающую роль в определении состава кишечника человека (24), а эффективность конкретной диеты в значительной степени зависит от исходного состава кишечной микробиоты (25).
Обширные исследования показали, что кишечная микробиота традиционного сельского населения (т. е. высоковолокнистая, низкожировая диета) более разнообразна и содержит различные таксоны, чем микробиота западных популяций (т. е. низковолокнистая, высокожировая диета) (26). Сохранение микробного разнообразия с помощью диеты с высоким содержанием клетчатки и низким содержанием жиров позволяет людям максимизировать потребление энергии из клетчатки, а также защищает их от воспаления и неинфекционных заболеваний толстой кишки. Хотя неясно, способствует ли увеличение микробного разнообразия защите от метаболических заболеваний, несколько метагеномных исследований показывают, что улучшение исходов при метаболических заболеваниях связано с увеличением микробного разнообразия (27, 28). Например, группа исследователей секвенировала микробиомы 169 человек с ожирением и 123 человека без ожирения и обнаружила, что люди делятся на две группы: группа с низким уровнем разнообразия микробных генов и группа с высоким разнообразием (27). Люди с меньшим количеством генов, как правило, имели более выраженное ожирение, инсулинорезистентность и дислипидемию, чем люди, содержащие более разнообразную микробиоту кишечника. Кроме того, люди с ожирением и меньшим бактериальным разнообразием со временем прибавляли в весе больше. Эти данные предполагают, что манипулирование разнообразием микробов в кишечнике может быть многообещающим средством улучшения метаболических нарушений.
Регулирования микробных метаболитов
Рис. 1. Взаимодействие между микробиотой кишечника и метаболизмом хозяина. На микробиоту кишечника может влиять целый ряд внешних факторов, в том числе состояние хозяина, тип диеты и медикаментозное лечение. Дисбаланс кишечной микробиоты может привести к серьезным метаболическим нарушениям (например, ожирению), изменяя чувствительность хозяина к инсулину или энергетический гомеостаз.
Микробная регуляция воспаления
Симбионты при метаболических заболеваниях
Таблица 1. Кишечная микробиота, связанная с ожирением
Gordon et al. сообщалось о фенотипах худых мышей, которые коррелировали с видами Bacteroides, такими как B. cellulosilyticus, B. uniformis, B. vulgatus, B. thetaiotaomicron и B. caccae (20). Пероральное введение штамма B. uniformis CECT 7771 улучшало вызванную HFD метаболическую дисфункцию у тучных мышей (62). Наша группа недавно сообщила, что мыши, получавшие HFD-корм, получавшие B. acidifaciens в течение 10 недель, набирали меньше жировой массы и массы тела, чем те, кто получал только PBS (45). Мы предположили, что активируемый пролифератором пероксисом рецептор α ( PPARα )-опосредованное окисление жира в жировых тканях и расширенный период полураспада GLP-1 участвуют в регуляции бактерией B. acidifaciens ожирения хозяина и инсулинорезистентности. Кроме того, метаболиты, секретируемые B. acidifaciens, могут играть критическую роль в поддержании низких уровней дипептидилпептидазы-4 ( DPP-4 ) в кишечнике (45) (Рис. 2). Было бы интересно провести последующее исследование, чтобы выявить лежащие в основе механизмы того, как работают полезные симбионты, а также растворимые факторы, продуцируемые этими бактериями и их перекрестными взаимодействиями.
Рис. 2. Предлагаемый механизм модуляции чувствительности к инсулину хозяина с помощью Bacteroides acidifaciens (BA). Выбранная комменсальная бактерия (например, BA) заставляет кишечные эпителиальные клетки секретировать меньшее количество дипептидилпептидазы-4 ( DPP-4 ) в кишечнике и повышенное количество глюкагоноподобного пептида-1 ( GLP-1 ), что может способствовать гомеостазу глюкозы. В то же время повышенные уровни желчных кислот (например, холата и таурина) могут способствовать активации GLP-1 в кишечнике и активации рецептора α ( PPARα ), активируемого пролифератором пероксисом, через TGR5 в жировой ткани, что в конечном итоге приводит к окислению жира и улучшению чувствительности к инсулину.
Выводы и перспективы
Если учесть связь между диетой, кишечными микробами и болезнями обмена веществ, скорее всего, тут нет ничего простого. Хотя механистические исследования на животных моделях дали ценную информацию и выявили потенциальные терапевтические цели, будущие исследования столкнутся с трудностями, связанными с переводом этих результатов на пациента-человека.
Метаболическое действие микробиоты и метабиотики
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
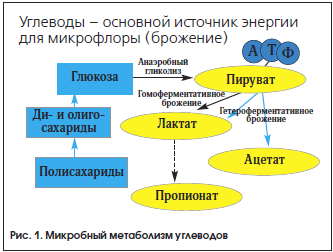
Микробиота кишечника выполняет важные функции, одна из которых – метаболическая. Микробиота активно участвует практически во всех видах обмена веществ, переваривая различные пищевые ингредиенты: белки, жиры и углеводы, синтезируя витамины. Важнейшими продуктами бактериального расщепления углеводов являются короткоцепочечные жирные кислоты (КЦЖК): уксусная, пропионовая и масляная. Положительные эффекты КЦЖК состоят в стимуляции роста бифидобактерий, подавлении патогенов, снижении уровня токсических метаболитов и канцерогенов, улучшении всасывания Na+, K+, Ca++, Mg++, Zn++; нормализации моторики ЖКТ, энергообеспечении организма, усилении гликогенеза в печени, уменьшении образования кетонов и противовоспалительном действии. Изменение спектра микробных метаболитов является одной из причин развития многих заболеваний кишечника, в т. ч. рака толстой кишки. Поскольку конечные продукты микробного метаболизма зависят как от характера питания, так и от состава микробиоты, прием готовых микробных метаболитов – метабиотиков обладает более предсказуемым эффектом. Они, в частности Хилак форте, эффективны в лечении ряда заболеваний кишечника.
Ключевые слова: метабиотики, микробиота кишечника, короткоцепочечные жирные кислоты, Хилак форте.
Для цитирования: Корниенко Е.А. Метаболическое действие микробиоты и метабиотики // РМЖ. 2016. № 18. С. 1196–1201.
Для цитирования: Корниенко Е.А. Метаболическое действие микробиоты и метабиотики. РМЖ. 2016;18:1196-1201.
Metabolic activities of microbiota and metabiotics
Kornienko E.A.
Saint Petersburg State Pediatric Medical University
Key words: metabiotics, intestinal microbiota, short chain fatty acids, Hylak forte
For citation: Kornienko E.A. Metabolic activities of microbiota and metabiotics // RMJ. 2016. № 18. P. 1196–1201.
В статье рассмотрено метаболическое действие микробиоты и метабиотики
Кишечную микробиоту называют «забытым органом», поскольку только в последние годы стало очевидно, что она не уступает по функциональной значимости другим органам человека. Одна из главных функций микробиоты – метаболическая. В соответствии с концепцией академика А.М. Уголева, существуют два пищевых потока, поступающих из кишечника в другие органы и ткани: первый – результат всасывания продуктов ферментативного гидролиза пищи, а второй – продуктов бактериального гидролиза, который не менее значим. Часть микробных метаболитов утилизируется в кишечнике, другая, довольно значительная часть, поступает через портальную вену в печень, а оттуда немного из них – с общим кровотоком в различные органы и ткани.
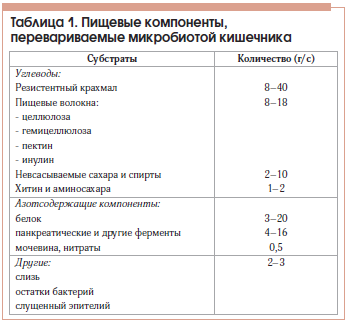
Кишечная микробиота при общей массе кишечных бактерий около 2–4 кг переваривает примерно 50 кг пищевых веществ за год. В таблице 1 представлено примерное количество перевариваемых микробиотой кишечника пищевых компонентов за сутки.
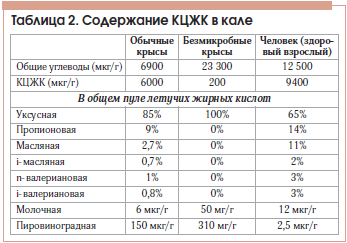
Важнейшими продуктами бактериального расщепления углеводов являются КЦЖК, прежде всего уксусная (С2), пропионовая (С3) и масляная (С4). Их концентрация в ТСК взрослого человека составляет 70–140 ммоль/л в ее проксимальных отделах и 20–70 ммоль/л – в дистальных. Безмикробные животные даже на диете, обогащенной ПВ, не дают прирост КЦЖК, что подтверждает микробное происхождение этих метаболитов (табл. 2).
ГК «Униконс»
Продвижение и реализация комплексных пищевых добавок, антисептиков и др. продукции.
«Антисептики Септоцил»
Септоцил. Бытовая химия, антисептики.
«Петритест»
Микробиологические экспресс-тесты. Первые результаты уже через 4 часа.
«АльтерСтарт»
Закваски, стартовые культуры. Изготовление любых заквасок для любых целей.
ЗАГРЯЗНЕНИЕ МИКРООРГАНИЗМАМИ И ИХ МЕТАБОЛИТАМИ
Загрязнение вызывает две формы заболеваний: пищевое отравление (пищевая интоксикация) и пищевую токсикоинфекцию.
ПИЩЕВАЯ ИНТОКСИКАЦИЯ:
ее вызывает токсин, продуцируемый микроорганизмом, который попадает и развивается в продуктах. Типичными примерами пищевой интоксикации являются стафилококковое отравление и ботулизм.
Пищевые интоксикации можно условно подразделить на бактериальные токсикозы и микотоксикозы.
Бактериальные токсикозы
В качестве примера можно привести стафилококковое пищевое отравление. Вызывается энтеротоксином, который продуцируется бактерией Staphylocосcus aureus (S. aureus) в период ее роста в пищевых продуктах. Идентифицировано шесть энтеротоксинов: A, B, C, D, E и F; выделены и получены две формы энтеротоксина С – С1 и С2.
Бактерия устойчива к нагреванию, сохраняет активность при 70 °С в течение 30 мин, при 80 °С – 10 мин. Еще более устойчивы к нагреванию энтеротоксины S. aureus, окончательная инактивация которых наступает только после 2,5-3 ч кипячения. S. aureus выдерживает высокие концентрации поваренной соли и сахара. Жизнедеятельность бактерии прекращается при концентрации хлорида натрия (поваренной соли) в воде более 12 %, сахара – 60 %, что необходимо учитывать при консервировании пищевых продуктов. При температуре 4-6 °С и ниже размножение S. aureus также прекращается. Оптимальная температура для размножения стафилококков – 22-37 °С.
Источником инфекции могут быть и человек, и сельскохозяйственные животные. Через последних заражается в основном молоко, мясо и продукты их переработки. У человека стафилококковая инфекция локализуется на кожных покровах, в носоглотке, кишечнике, других органах и тканях.
Попадая в продовольственное сырье, пищевые продукты и кулинарные изделия, стафилококки продуцируют токсины с различной интенсивностью, зависящей от уровня обсеменения, времени и температуры хранения, особенностей химического состава объекта загрязнения (содержание белков, жиров, углеводов, витаминов, pН среды и т. д.). Наиболее благоприятная среда для жизнедеятельности бактерий – молоко, мясо и продукты их переработки, поэтому именно эти пищевые продукты чаще вызывают стафилококковое отравление.
Молоко и молочные продукты
Загрязнение молока стафилококками может происходить от коров, больных маститом, при контакте с кожными покровами больных животных и человека, занятого переработкой молока. Отмечено, что стафилококки размножаются и продуцируют энтеротоксины в сыром молоке слабее, чем в пастеризованном, поскольку они являются плохим конкурентом в борьбе с другими микроорганизмами молока. Этим объясняется отсутствие энтеротоксинов и стафилококков в кисломолочных продуктах, для закваски которых используются активные молочные культуры. Кроме того, молочная кислота, образующаяся в процессе изготовления этих продуктов, тормозит размножение данных микроорганизмов.
Попадая в молоко, стафилококк начинает продуцировать энтеротоксины при комнатной температуре через 8 ч, при 35-37 °С – в течение 5 ч. При обсеменении стафилококками молодого сыра энтеротоксины выделяются на 5-й день его созревания в условиях комнатной температуры. По истечение 47-51 дня хранения сыра происходит гибель стафилококков, энтеротоксины же сохраняются еще в течение 10-18 дней.
В других молочных продуктах энтеротоксины можно обнаружить, если эти продукты были изготовлены из молока и молочных смесей, обсемененных стафилококками.
Мясо и мясные продукты
Загрязнение мяса стафилококками происходит во время убоя животных и переработки сырья. Как и в сыром молоке, конкурирующая микрофлора не дает возможности быстрого размножения этих бактерий в сыром мясе. В определенных технологических условиях, особенно при ликвидации конкурирующей микрофлоры, стафилококки могут активно размножаться в мясопродуктах и продуцировать энтеротоксины.
В мясном фарше, сыром и вареном мясе стафилококки продуцируют токсины при оптимальных условиях (22-37 °С) через 14-26 ч. Добавление в фарш белого хлеба увеличивает скорость образования токсических метаболитов в 2-3 раза. Концентрация соли, используемая для посола, не ингибирует S. aureus; уровень pН мяса и мясных продуктов, предотвращающий развитие бактерий, должен быть не выше 4,8. Копчение колбас при определенной температуре способствует росту стафилококков. В готовых котлетах, после их обсеменения, энтеротоксины образуются через 3 ч, в печеночном паштете – через 10-12 ч. Вакуумная упаковка мясопродуктов ингибирует рост стафилококков.
Для мяса птицы описанные выше данные аналогичны. Стафилококки не проникают и не растут в целых сырых яйцах. При тепловой обработке яиц их бактериостатические свойства уничтожаются, и они могут заражаться стафилококками в результате мойки и хранения.
Другие пищевые продукты
Благоприятной средой для размножения S. aureus являются мучные кондитерские изделия с заварным кремом. При обсеменении крема в условиях благоприятной для бактерий температуры (22–37 °С) образование токсинов наблюдается через 4 ч. Концентрация сахара в таких изделиях обычно составляет менее 50 %; содержание сахара в количестве 60 % и выше ингибирует образование энтеротоксинов.
Микотоксикозы
Наиболее распространенные и хорошо изученные микотоксикозы – афлатоксикоз (см. раздел 3.2.1), фузариотоксикоз и эрготизм.
Фузариотоксикозы
Согласно принятой в нашей стране классификации, к фузариотоксикозам относят следующие заболевания:
1. Алиментарно-токсическая алейкия – вызывается продуцентами микроскопических грибов Fusarium sporotrichiella var. Болезнь поражает как людей, так и сельскохозяйственных животных. Заболевание затрагивает кроветворные органы. У человека количество лейкоцитов снижается до 1000 и менее в 1 мм3, количество эритроцитов повышается до 1800 тыс., что служит наиболее ранними и объективными показателями алиментарно-токсической алейкии. Вспышки заболевания наблюдались у людей после употребления хлеба, изготовленного из пораженного зерна.
2. Отравление «пьяным хлебом». Болезнь обусловлена воздействием на организм токсического продуцента гриба Fusarium graminearum. Токсины гриба обладают нейротропным действием, сходным с действием алкоголя, отсюда и название болезни.
3. Уровская болезнь (болезнь Кашина – Бека). Впервые заболевание выявлено в 1860 г. Н. И. Кашиным у населения, проживающего в долине р. Уровы (Восточная Сибирь). В 1906 г. болезнь повторно зарегистрирована и изучена Е. В. Беком. Предполагают, что болезнь вызывается токсинами гриба Fusarium sporotrichiellavappoae, который поражает злаковые культуры. Болезнь проявляется в нарушении остеогенеза у детей, подростков и юношей, задержке роста отдельных костей, деформации скелета. Другая гипотеза связывает возникновение уровской болезни с высоким содержанием стронция в географической зоне проживания этих людей на фоне низкого содержания кальция.
Имеется ряд других данных по этиологии рассматриваемого заболевания, что свидетельствует о необходимости проведения специальных исследований и выявления истинных причин заболевания.
Эрготизм
Возникает при употреблении изделий из зерна, зараженного спорыньей. Последняя представляет собой склероции гриба Claviceps purpurea, содержит высокотоксичные алкалоиды (эрготоксин, эрготамин, эргометрин) и биогенные амины (гистамин, тирамин и др.). Эти соединения могут поражать нервную систему (судорожная форма) или нервно-сосудистый аппарат (гангренозная форма).
Ядовитые соединения спорыньи устойчивы при термической обработке и хранении хлебопродуктов. Гигиенические нормы допускают содержание спорыньи в муке не более 0,05 %.
Вопросам загрязнения пищевых продуктов микотоксинами и профилактики алиментарных микотоксикозов посвящен раздел 3.2.1.
ПИЩЕВАЯ ТОКСИКОИНФЕКЦИЯ: ее вызывают микроорганизмы – вирусы, сальмонеллы и др., – попавшие в продукт в большом количестве. Загрязнение пищевых продуктов происходит в основном бактериями, риккетсиями, вирусами, плесенями и паразитами.
Clostridium perfringens – спорообразующие анаэробные грамположительные бактерии, широко распространенные в природе вследствие своей стойкости к различным воздействиям. Вегетативные клетки бактерий имеют вид прямых толстых палочек размером 2–6 × 0,8–1,5 мкм. Изучено шесть штаммов Cl. perfringens: A, B, C, D, E и F, которые продуцируют многообразные по своим свойствам токсины. Пищевую токсикоинфекцию вызывают главным образом штаммы А и D. Токсикологическую картину при этом определяет А-токсин. Cl. perfringens развивается при температуре от 15 до 50 °С и рН 6,0–7,5. Оптимальные температура 45 °С и рН 6,5 обеспечивают продолжительность генерации около 10 мин. Энтеротоксины высвобождаются из вегетативных клеток в период образования из этих клеток зрелых спор. Это может происходить и в пищевых продуктах, и в кишечнике человека.
Источником заболевания служат в основном продукты животного происхождения – мясные и молочные, обсеменение которых происходит как при жизни животных (больных и бациллоносителей), так и после убоя (при нарушении санитарно-гигиенических норм переработки и хранения сырья). Источниками инфекции могут быть рыба и морепродукты, бобовые, картофельный салат, макароны с сыром.
После попадания инфекции в организм инкубационный период длится от 5 до 22 ч. Характерные признаки заболевания – понос, спазмы и боли в животе.
Профилактические мероприятия предусматривают соблюдение санитарно-гигиенических требований при переработке сырья, хранении готовой продукции.
Бактерии рода Salmonella. Изучено более 2000 серологических типов сальмонелл. Бактерии представляют собой грамположительные палочки, не образующие спор, длиной от 2 до 3 мкм и шириной около 0,6 мкм.
Существует три основных типа сальмонеллеза: брюшной тиф, гастроэнтерит и септицемия. Каждый штамм сальмонеллы способен вызвать любой из указанных выше клинических типов инфекции.
80-90 % сальмонеллезов вызывается четырьмя видами этих бактерий. Сальмонеллы характеризуются устойчивостью к воздействию различных физико-химических факторов. Растут при температуре от 5,5 до 45 °С, оптимальная – 37 °С. Сохраняют жизнеспособность при охлаждении до 0 °C в течение 142 дней, при температуре 10 °С – 115 дней. Нагревание до 60 °С приводит к гибели сальмонелл через 1 ч, при 70 °С – через 15 мин, при 75 °С – 5 мин, при кипячении наступает мгновенная гибель.
Заражение пищевых продуктов сальмонеллами может происходить как через животных, так и через человека.
Основные пищевые продукты, передающие сальмонеллезные токсикоинфекции, – мясо и мясопродукты, обсеменение которых осуществляется и при жизни животных, и после их убоя.
Животные, больные сальмонеллезами, выделяют сальмонеллы с молоком, следовательно, молоко и молочные продукты также способствуют распространению сальмонеллезных токсикоинфекций. Кроме того, переносчиками сальмонелл могут быть работники пищевых предприятий, болеющие скрытыми формами сальмонеллезов или являющиеся бактерионосителями.
Особую роль в этиологии сальмонеллеза играют прижизненно зараженные пищепродукты: яйца, мясо уток, гусей, кур, индеек.
1. Работа ветеринарно-санитарной службы непосредственно в хозяйствах по выявлению животных и птицы, больных сальмонеллезом.
2. Проведение санитарно-ветеринарной экспертизы во время первичной переработки сырья и изготовления продуктов питания.
Необходимо соблюдать санитарные требования по размораживанию мяса, хранить сырье и полуфабрикаты при температуре не выше 4–8 °С, использовать холод на всех этапах производственного процесса, включая транспортировку сырья, полуфабрикатов и готовой продукции, соблюдать сроки реализации, установленные для каждого продукта, а также режимы тепловой обработки. Последнее имеет принципиальное значение в предупреждении сальмонеллезных токсикоинфекций, учитывая губительное действие нагревания (не ниже 80 °С) на бактерии. Не разрешается реализация населению некипяченого и непастеризованного молока.
3. Осуществление систематической борьбы с грызунами как источником обсеменения сырья и продуктов на пищевых предприятиях.
4. Соблюдение соответствующих санитарных требований в отношении воды, льда, инвентаря, посуды и оборудования.
5. На предприятиях пищевой промышленности и общественного питания:
Пункты 3–5 имеют значение в профилактике заражения сальмонеллезом продуктов растительного происхождения, хотя такие случаи встречаются редко.
Бактерии рода Escherichia coli. Патогенные штаммы кишечной палочки способны размножаться в тонком кишечнике, вызывая токсикоинфекцию (основной симптом болезни – водянистый понос). Источником патогенных штаммов могут быть люди и животные. Обсеменяются продукты и животного, и растительного происхождения. Пути заражения те же, что и при сальмонеллезах.
1. Выявление и лечение работников пищевых предприятий – носителей патогенных серотипов кишечной палочки.
2. Осуществление ветеринарного надзора над животными. Мясо животных, больных колибацеллезом, считается условно годным и подлежит специальной тепловой обработке.
3. Выполнение санитарных норм и режимов технологии изготовления и хранения пищевых продуктов.
4. Соблюдение санитарного режима на предприятии (мытье и дезинфекция инвентаря и оборудования и т. д.).
Бактерии рода Proteus. Род Proteus включает пять видов. Возбудители пищевых токсикоинфекций – в основном Pr. mirasilis и Pr. vulgaris. Оптимальные условия для развития этих бактерий – температура 25–37 °С. Выдерживают нагревание до 65 °С в течение 30 мин, рН в пределах 3,5–12, отсутствие влаги – до 1 года, высокую концентрацию поваренной соли (13–17 %) – в течение 2 суток. Все это свидетельствует об устойчивости Proteus к воздействию внешних факторов среды.
Причинами возникновения протейных токсикоинфекций могут быть наличие больных сельскохозяйственных животных, антисанитарное состояние пищевых предприятий, нарушение принципов личной гигиены. Основные продукты, через которые передается это заболевание, – мясные и рыбные изделия, реже блюда из картофеля. Отмечены случаи заражения других пищевых продуктов.
Энтерококки. Потенциально патогенными штаммами среди энтерококков (Streptococcus faecalis) являются Str. faecalis var. Liguefaciens и Str. faecalis var. Zumogenes. Размножаются при температуре от 10 до 15 °С. Устойчивы к высыханию, воздействию низких температур, выдерживают 30 мин при 60 °С; погибают при 85 °С в течение 10 мин.
Источники инфекции – человек и животные. Пути обсеменения пищевых продуктов такие же, что и при других видах токсикоинфекций.
Ботулизм – представляет собой тяжелое пищевое отравление, вызывается токсинами, выделяемыми Clostridium botulinum. Изучено семь видов токсинов – А, В, С, D, Е, F и G. Наиболее токсичны ботулотоксины А и Е.
Бактерии Cl. botulinum широко распространены в окружающей среде. В виде спор попадают в почву при удобрении ее навозом, поэтому продукты растительного происхождения загрязняются спорами через почву.
Споры, по сравнению с вегетативной формой Cl. botulinum, устойчивы к воздействию физико-химических факторов окружающей среды. При 100 °С
они сохраняют жизнеспособность в течение 6 ч, при 120 °С – 10 мин. Споры прорастают при концентрации хлорида натрия до 6–8 %. Размножение бактерий прекращается при рН 4,4 и температуре 12–10 °С и ниже, при 80 °С они погибают в течение 15 мин. Оптимальной для жизнедеятельности Cl. botulinum является температура 20-37 °С.
Ботулотоксины характеризуются высокой устойчивостью к действию протеолитических ферментов, кислот и низких температур, однако инактивируются под влиянием щелочей и высокой температуры: при 80 °С – через 30 мин, при 100 °С – через 15 мин.
Описанные свойства вегетативных форм Cl. botulinum, спор и токсинов должны учитываться в технологии изготовления пищевых продуктов.
1. Предупреждение загрязнения туш сельскохозяйственных животных частицами земли, навоза, а также в процессе их разделки – содержимым кишечника; посол в условиях холода; соблюдение режимов термической обработки.
2. Использование свежего растительного сырья; предварительная мойка и тепловая обработка; стерилизация продукта с целью предупреждения прорастания cпор, размножения вегетативных форм и образования токсинов.
3.2.1. Микотоксины в пищевых продуктах, профилактика алиментарных микотоксикозов
Микотоксины (от греч. mỳkēs – гриб) (МТ) представляют собой вторичные метаболиты микроскопических плесневых грибов. Из кормов и продуктов питания выделено около 30 тыс. видов плесневых грибов, большинство из которых продуцируют высокотоксичные метаболиты, в частности более 120 микотоксинов. С биологических позиций, микотоксины выполняют в обмене микроскопических грибов функции, направленные на их выживание и конкурентоспособность в борьбе за место в различных экологических нишах. С гигиенических позиций – это особо опасные токсичные вещества, загрязняющие корма и пищевые продукты.
По данным ФАО, более 10 % пищевых продуктов и кормов ежегодно теряется вследствие поражения плесневыми грибами.
В продуктах питания и продовольственном сырье наиболее распространены следующие высокотоксичные МТ: афлатоксины, стеригматоцистин, охратоксины, патулин, исландитоксин, зеараленон, рубратоксины, цитреовиридин и др. В табл. 24 представлены сведения об изученных в настоящее время мико-
токсинах, их продуцентах и о характере токсического действия.
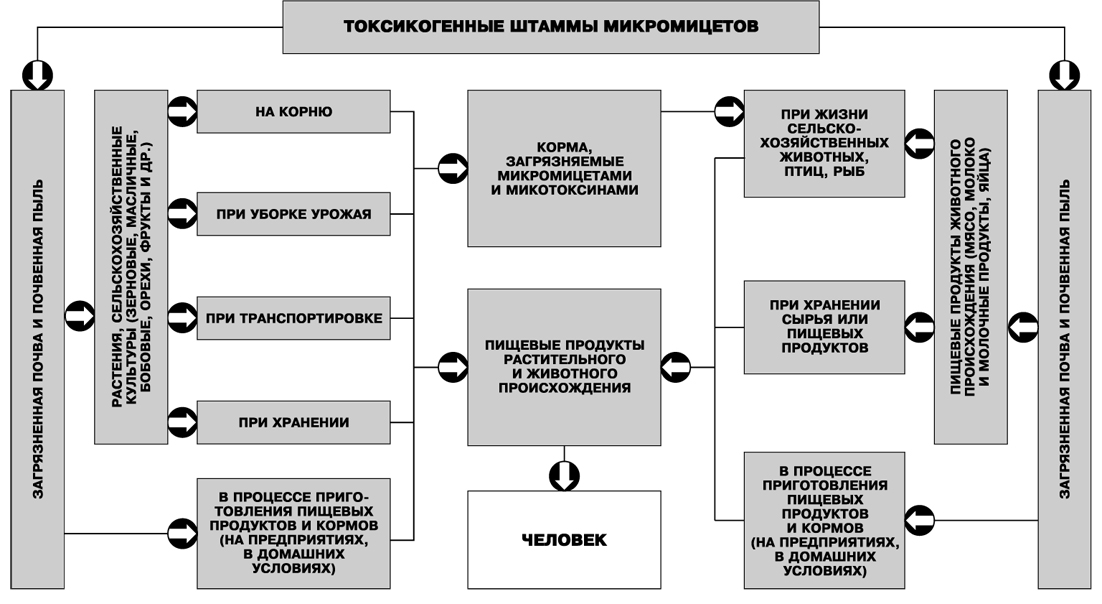
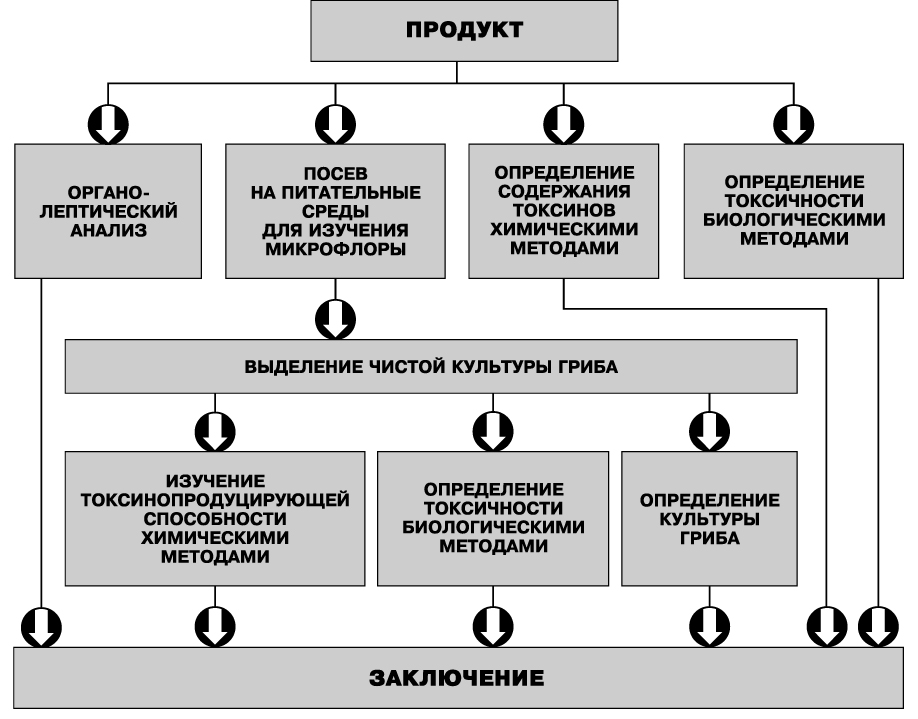
На рис. 9 показаны пути загрязнения пищевых продуктов токсигенными штаммами микромицетов и микотоксинами.
Рассмотрим наиболее типичных токсичных представителей микотоксинов, а также микотоксикозы, которые они вызывают.
Рис. 9. Основные пути загрязнения пищевых продуктов токсигенными штаммами микромицетов и микотоксинами
Основные сведения о микотоксинах
Афлатоксины (АТ). Наиболее опасны и лучше изучены. Продуцируются главным образом грибами Aspergillius flavus и A. parasiticus. К семейству АТ относится более 20 соединений, 4 из которых – основные: В1, В2, G1, G2. Остальные – их производные или метаболиты. Наиболее токсичные и широко распространенные АТ – В1.
Немаловажный интерес в плане загрязнения пищевых продуктов представляет АТ М1, который является метаболитом АТ В1 и выделяется с молоком у животных после употребления зараженного корма.
АТ характеризуются широким спектром токсического действия (см. табл. 24), ЛД50 (летальная доза – наименьшая доза, вызывающая смертность 50 % подопытных животных) АТ В1 для человека составляет около 2 мг на 1 кг массы тела.
Заболевание, вызываемое АТ, получило название афлатоксикоз. Основную роль в механизме токсического действия АТ играет нарушение проницаемости мембраны субклеточных структур и подавление синтеза ДНК и РНК. Последнее приводит к нарушению синтеза митохондральных белков и липидов, других обменных процессов, что проявляется в ряде серьезных клинических заболеваний.
Наряду с общетоксическим действием проявляется канцерогенная, мутагенная (генные и хромосомные мутации), тератогенная, гонадотоксическая и эмбриотоксическая активность АТ, что делает проблему профилактики алиментарных афлатоксинов особо актуальной.
Качественный и количественный состав рациона оказывает значительное влияние на токсический эффект АТ. Этот эффект усиливается при дефиците белков, незаменимых жирных кислот и ретинола. При избытке белков также наблюдается усиление канцерогенного действия, что объясняется снижением активности эпоксидгидролазы и глутатионтрансферазы – ферментов, ответственных за детоксикацию АТ и их метаболитов.
Согласно данным ВОЗ, человек при благоприятной гигиенической ситуации потребляет с суточным рационом не более 0,19 мкг АТ, что не оказывает отрицательного воздействия на организм. Однако чем выше суточная доза АТ (например, в Мозамбике – до 15,5 мкг), тем вероятнее заболеваемость первичным раком печени.
В России ПДК АТ В1 для всех пищевых продуктов, кроме молока, составляет 5 мкг/кг, для молока и молочных продуктов – 1 мкг/кг; АТ М1 – 0,5 мкг/кг.
Рис. 10. Санитарно-микологический анализ пищевых продуктов
как часть системы мер профилактики микотоксикозов
Допустимая суточная доза этих веществ для взрослого человека массой 60 кг – в пределах 0,3–0,6 мкг (0,005–0,010 мкг/кг массы тела).
Патулин, продуцируемый пенициллами и аспергиллами, обнаруживается преимущественно в продуктах, полученных из заплесневелых фруктов и ягод. Во фруктовых и овощных соках, пюре для взрослых показатель ПДК патулина составляет 50 мкг/кг, для детского питания – 20 мкг/кг.
Система мер профилактики микотоксикозов включает в себя санитарно-микологический анализ пищевых продуктов (рис. 10). Кроме этого, много внимания уделяется изысканию способов деконтаминации и детоксикации сырья и пищевых продуктов, загрязненных АТ. С этой целью используют механические, физические и химические методы:
Механические и физические методы очистки нельзя считать высокоэффективными, кроме того, химические методы вызывают разрушение не только АТ, но и полезных нутриентов, а также приводят к нарушению их всасывания.
Допустимые уровни содержания микотоксинов в отдельных группах пищевых продуктов
При профилактике алиментарных микотоксикозов основное внимание уделяют зерновым культурам. В этой связи необходимо соблюдать следующие меры по предупреждению загрязнения зерновых культур и пищевых продуктов:
Важной задачей является выведение сортов, устойчивых к аспергиллам. Допустимые уровни содержания микотоксинов в отдельных группах пищевых продуктов представлены в табл. 25.
Установленные медико-биологическими требованиями и санитарными нормами качества продовольственного сырья и пищевых продуктов критерии безопасности включают определение следующих четырех групп микроорганизмов:
I группа – санитарно-показательные микроорганизмы. Определение мезофильных аэробных и факультативно-анаэробных микроорганизмов, что выражается количеством колониеобразующих единиц (КОЕ) в 1 г или 1 см 3 продукта. Показатель «Бактерии группы кишечных палочек» (БГКП) практически идентичен показателю «Колиформные бактерии». К этой группе относят грамотрицательные, не образующие спор палочки с учетом как цитратотрицательных, так и цитратположительных вариантов БГКП, включая роды: Escherichia, Klebsiella, Enterobacter, Citrobacter, Serratia.
II группа – потенциально патогенные микроорганизмы: коагулазоположительный стафилококк, Bacillus cereus, сульфитредуцирующие клостридии, бактерии рода Protea, парагемолитические галофильные вибрионы.
III группа – патогенные микроорганизмы, в том числе сальмонеллы.
Микробиологические исследования проводят в соответствии с ГОСТ, СанПиН, методическими указаниями, методическими инструкциями, другими нормативными документами, содержащимися в медико-биологических требованиях (МБТ).