Что вызывает внутрибрюшное давление
Интраабдоминальная гипертензия
Интраабдоминальная гипертензия (ИАГ; англ. abdominal compartment) — увеличение давления внутри брюшной полости выше нормы, следствием которой может стать нарушение функций сердца, лёгких, почек, печени, кишечника пациента.
У здорового взрослого человека внутрибрюшное давление составляет от 0 до 5 мм рт.ст. У взрослых пациентов в критическом состоянии внутрибрюшное давление до 7 мм.рт.ст. также считается нормальным. При ожирении, беременности и некоторых других состояниях возможен хронический подъем внутрибрюшного давления до 10–15 мм рт.ст., к которым человек успевает адаптироваться и которые не играют большой роли по сравнению с резким повышением внутрибрюшного давления. При плановой лапаротомии (хирургическом разрезе передней брюшной стенки) может достигать 13 мм рт.ст.
В 2004 году на конференции World Society of the Abdominal Compartment Syndrome (WSACS) было принято следующее определение: интраабдоминальная гипертензия — это устойчивое повышение внутрибрюшного давления до 12 мм рт.ст. и более, которое регистрируется как минимум при трех стандартных измерениях с интервалом в 4–6 часов.
Внутрибрюшное давление отсчитывается от уровня среднеподмышечной линии при положении пациента на спине в конце выдоха при отсутствии мышечного напряжения передней брюшной стенки.
Инттаабдоминальная гипертензия может развиваться вследствие тяжелой закрытой травмы живота, перитонита, панкреонекроза, других заболеваний органов брюшной полости и оперативных вмешательств.
По данным исследования, проведенного в Западной Европы, интраабдоминальная гипертензия выявляется у 32 % пациентов, поступающих в отделений реанимации и интенсивной терапии. У 4,5 % этих пациентов развивается синдром интраабдоминальной гипертензии. При этом развитие интраабдоминальной гипертензии в период нахождения больного в отделениях реанимации и интенсивной терапии является независимым фактором летального исхода, имеющей относительный риск примерно 1,85 %.
Синдром интраабдоминальной гипертензии
Интраабдоминальная гипертензия приводит к нарушениям многих жизненно важных функций органов, находящихся в брюшине и соседствующих с ней (развивается полиорганная неодостаточность). В результате развивается синдром интраабдоминальной гипертензии (СИАГ; англ. abdominal compartment syndrome). Синдром интраабдоминальной гипертензии — симптомокомплекс, развивающийся вследствие повышения давления в брюшной полости и характеризующийся развитием полиорганной недостаточности.
Интраабдоминальная гипертензия не всегда приводит к развитию СИАГ.
Публикации для профессионалов здравоохранения, затрагивающие проблематику СИАГ
Методы измерения внутрибрюшного давления
Измерение давления непосредственно в брюшной полости возможно при лапороскопии, при наличии лапоростомы или при перитониальном диализе. Это наиболее корректный метод измерения внутрибрюшного давления, однако он достаточно сложен и дорог, поэтому на практике используют непрямые методы, при которых производят измерения в полых органах, чья стенка находится в брюшной полости (соседствует с ней): в мочевом пузыре, прямой кишке, бедренной вене, матке и других.
Наибольшее распространение получила методика измерения давления в мочевом пузыре. Метод позволяет осуществлять мониторинг за данным показателем на протяжении длительного срока лечения больного. Для измерения давления в мочевом пузыре используют катетер Фолея, тройник, прозрачную трубку от системы для переливания крови, линейку или специальный гидроманометр. При измерении пациент находится на спине. В асептических условиях в мочевой пузырь вводится катетер Фолея, раздувается его баллончик. В мочевой пузырь, после его полного опорожнения, вводится до 25 мл физиологического раствора. Катетер пережимается дистальнее места измерения, и к нему с помощью тройника подключается прозрачная трубочка от системы. Уровень давления в брюшной полости оценивается по отношению к нулевой отметке – верхнему краю лонного сочленения. Через мочевой пузырь давление в брюшной полости не оценивают при его травме, а также при сдавлении пузыря тазовой гематомой. Измерение пузырного давления не производят, если существует повреждение мочевого пузыря или сдавление его тазовой гематомой. В этих случаях оценивают внутрижелудочное давление. Для этих целей (а также при измерении давления в других полых органах, в том числе, в мочевом пузыре) возможно применение аппаратуры, измеряющих давление по водно-перфузионному принципу, например, прибора «Гастроскан-Д».
Синдром портальной гипертензии
Введение
Кровь, питающая ряд органов брюшной полости, отводится по единому венозному руслу. Эта вена называется (учитывая ее расположение) воротной или портальной веной печени; она имеет множество ответвлений и является наиболее крупной веной в организме человека, достигая в диаметре 8-12 мм. Как и в любом ином магистральном кровеносном сосуде, в воротной вене должно постоянно поддерживаться определенное кровяное давление – здесь оно в норме составляет от 5-7 до 10-12 мм рт. ст. Хроническое превышение этого уровня приводит к общим нарушениям гемо- и гидродинамики брюшной полости, дегенеративным изменениям в тканях и другим тяжелым последствиям, которые в совокупности образуют синдром портальной гипертензии.
По определению, синдром не является самостоятельным заболеванием; это устойчивое, повторяющееся сочетание взаимосвязанных клинических симптомов, которое может формироваться в силу разных причин, но обладает собственными специфическими закономерностями развития и протекания. Это в полной мере касается и синдрома портальной гипертензии.
Причины
Выделяют две основные группы причин развития портальной гипертензии: внепеченочные и внутрипеченочные. На этих же критериях (конкретная локализация блока воротной вены) построены общепринятые ее классификации, обычно включающие под- или предпеченочную форму, внутрипеченочную (с несколькими подтипами), надпеченочную и смешанную.
Согласно доступной медицинской статистике, наиболее распространенной (85-90%) является внутрипеченочная локализация нарушений портально-венозного оттока. В этиологическом плане внутрипеченочная портальная гипертензия чаще всего обусловлена циррозом печени или иным процессом дегенеративного замещения паренхиматозных клеток соединительной тканью.
Предпеченочная форма составляет 10-12% в общем объеме портальной гипертензии и, как правило, развивается вследствие механического давления (например, злокачественной опухолью), врожденных или приобретенных аномалий анатомического строения вены, воспалительного процесса в миокарде, обструктивного тромбоза Бадда-Киари и пр.
Частота надпеченочной (постпеченочной) формы не превышает 3-4%; причинами обычно становятся прорастание опухоли, тромбоз, эндофлебит печеночных вен.
В целом, к перечню этиопатогенетических факторов портальной гипертензии следует добавить все разновидности гепатитов, онкозаболевания, патологию билиарной (желчевыводящей) и сердечнососудистой систем, последствия травм и некоторых хирургических вмешательств, отравления (медикаментами, грибами, соединениями меди и пр.), ожоги. Кроме того, портальная гипертензия нередко развивается на фоне жизнеугрожающих состояний в ходе реанимационных мероприятий.
Симптоматика
Классическая триада симптомов включает варикозное расширение вен пищевода и верхних отделов желудка (в 85% случаев), спленомегалию (селезенка в той или иной степени увеличена практически всегда) и асцит (массивное скопление жидкости в брюшной полости).
Ранние проявления синдрома портальной гипертензии могут быть неспецифическими: признаки диспепсии (абдоминальные боли и тяжесть в животе, тошнота, различные проблемы с дефекацией, метеоризм и т.д.). Кроме того, по мере нарастания выраженности нарушений кровоснабжения печени снижается ее способность к выполнению дезинтоксикационных функций, что отражается и на функционировании мозга, – развивается т.н. печеночная энцефалопатия с присущей ей психоневрологической симптоматикой. При тяжелой печеночной недостаточности наблюдается желтуха. Прямую угрозу жизни несут (и нередко приводят к летальному исходу) внутренние кровотечения из растянутых и истонченных венозных стенок.
Выраженность, стадийность и скорость появления симптомов в значительной мере различаются при разных типах портальной гипертензии. Так, «водянка живота» (асцит) в одних случаях развивается постепенно, в других остро, и т.д.
Диагностика
Диагноз устанавливается путем сопоставления жалоб, анамнестических данных, результатов клинического осмотра и инструментального обследования. В частности, необходимой и обязательной является ФГДС (фиброгастродуоденоскопия), в ходе которой визуализируются вены пищевода и желудка, оценивается их статус и собирается другая клинически значимая информация. Назначают УЗИ в дуплекс-режиме, рентгенографию, по необходимости – дополнительные методы исследования селезенки и гепатобилиарной системы (сканирование печени, спленоманометрия, спленопортография, КТ, МРТ и т.д.).
Лечение
Синдром портальной гипертензии, в целом, весьма проблематичен в терапевтическом плане. Амбулаторное консервативное лечение и курсы поддерживающей терапии могут занимать несколько лет; назначаются «прицельные» гипотензивные средства для снижения давления в воротной, нижней полой и печеночных венах, вазо- и гепатопротекторы. Однако с усугублением ситуации амбулаторное лечение становится все менее эффективным, и пациента приходится госпитализировать, – сроки стационарного лечения варьируют от двух недель до месяца и более.
Масштабы и цели хирургического вмешательства, – если оно целесообразно и необходимо, – определяются особенностями конкретного случая: в различных ситуациях основной задачей может быть восстановление венозной проходимости, коррекция путей отвода крови, удаление из брюшной полости избыточной жидкости при асците, склерозирование расширенных и кровоточащих вен пищевода, и т.д. Однако относительными или абсолютными противопоказаниями к операции могут становиться сопутствующие хронические заболевания, беременность, пожилой возраст, тяжелое общее состояние пациента (обусловленное, например, выраженной печеночной недостаточностью).
Отдаленный прогноз при некоторых формах синдрома портальной гипертензии (внутрипеченочная, надпеченочная) неблагоприятен, особенно при пищеводно-желудочных геморрагиях у больных циррозом печени. В других случаях оперативное вмешательство может значительно улучшить ситуацию. Однако единственным радикальным лечением в настоящее время остается трансплантация печени.
Что вызывает внутрибрюшное давление
Позвоночник является одним из важнейших сегментов человеческого организма. Помимо опорной и двигательной функций позвоночный столб играет значительную роль в защите спинного мозга. Вместе с тем структурные элементы позвоночника (позвонки) могут совершать движения друг относительно друга, что достигается наличием обширного анатомо-физиологического аппарата, состоящего из суставов, межпозвонковых дисков, а также большого количества мышечных волокон и связок. Несмотря на достаточно высокую прочность позвоночного столба, обеспечиваемую этим аппаратом, нагрузки, которые испытывает человек в процессе своей жизнедеятельности, могут привести к негативным последствиям, таким как боли в спине, остеохондроз, межпозвонковые грыжи и т.д. [15, 17, 18, 22]. Наиболее уязвимой с точки зрения болей в спине и заболеваний, связанных с перегрузками межпозвонковых дисков, является нижняя часть поясничного отдела позвоночника. Различные исследования показывают, что чаще всего указанные патологии проявляются при резком или периодическом поднятии тяжестей. Одним из способов защиты от такого рода перегрузок является внутрибрюшное давление.
Поясничный отдел позвоночника
Поясничный отдел позвоночного столба располагается в брюшной полости и включает в себя пять позвонков (рис. 1). Из-за большой осевой нагрузки, приходящейся на поясничный отдел, эти позвонки имеют наибольшие размеры.
Между смежными позвонками располагаются межпозвонковые суставы, межпозвонковые диски, связки и мышечные волокна, в совокупности обеспечивающие подвижность и стабильность элементов поясничного отдела. Наибольший интерес в этом сегменте представляют межпозвонковые диски, анализ напряжённо-деформированного состояния (НДС) которых является важнейшей задачей в профилактике и лечении распространённых патологических состояний поясничного отдела позвоночника [2].
Рис. 1. Поясничный отдел позвоночника
Вместе с тем многочисленные исследования доказывают зависимость механических напряжений, возникающих в поясничных межпозвонковых дисках, от активности мышц спины [21, 23]. Таким образом, давление, возникающее за счёт силы тяжести в вертикальном положении туловища, не является первоочередным фактором перегрузки этих дисков. Наибольшую опасность в данном смысле представляет чрезмерное сокращение мышцы, выпрямляющей позвоночник (m. erector spinae [3]). В процессе поднятия тяжестей (рис. 2) активность m. erector spinae способствует поддержанию естественного расположения позвонков. Однако в тех случаях, когда вес поднимаемого груза достаточно велик, удержание позвоночника требует сильного сокращения волокон мышцы, выпрямляющей позвоночник, что может привести к значительной компрессии межпозвонковых дисков в поясничной области. Это, в свою очередь, влечёт за собой появление болей в спине, а также другие негативные эффекты.
Рис. 2. Схематическое изображение поднятия тяжести с выпрямленной спиной
Экспериментальное определение механических напряжений внутри межпозвонковых дисков человека практически неосуществимо. Поэтому большинство исследований в данном направлении основываются на результатах биомеханического моделирования, имеющих оценочный характер. Для получения точных характеристик НДС межпозвонкового диска необходимо знать механические взаимосвязи в позвоночно-двигательном сегменте, которые на сегодняшний день являются недостаточно изученными.
Биомеханический анализ ситуации, изображённой на рис. 2, проведён во множестве исследований (см., например, [5, 8, 10, 12]). При этом различными авторами были получены различные данные. Тем не менее все они сходятся на том, что в процессе поднятия тяжестей нагрузка на поясничные межпозвонковые диски возрастает в несколько раз по отношению к физиологическим усилиям, действующим на поясничный отдел позвоночного столба в вертикальном положении тела.
Брюшная полость – пространство, расположенное в туловище ниже диафрагмы и целиком заполненное внутренними органами. Сверху брюшное пространство ограничено диафрагмой, сзади – поясничным отделом позвоночного столба и мышцами поясницы, спереди и с боков – мышцами живота, снизу – диафрагмой таза [3].
При несоответствии объёма внутрибрюшного содержимого объёму, ограниченному оболочкой брюшной полости, возникает внутрибрюшное давление, т.е. взаимная компрессия внутрибрюшных масс и их давление на оболочку брюшной полости [4].
Внутрибрюшное давление измеряется в конце выдоха в горизонтальном положении при отсутствии напряжений мышц брюшной стенки с помощью датчика, обнуляемого на уровне средне-подмышечной линии. Эталонным является измерение внутрибрюшного давления через мочевой пузырь. Нормальный уровень внутрибрюшного давления у человека в среднем колеблется от 0 до 5 мм рт. ст. [24].
Причины повышения внутрибрюшного давления можно условно разделить на физиологические и патологические. К первой группе причин можно отнести, к примеру, сокращение мышц брюшного пресса, беременность и т.д. Патологический рост внутрибрюшного давления может быть вызван перитонитом, кишечной непроходимостью, накоплением жидкостей или газов в полости живота и др. [1].
Устойчивое повышение внутрибрюшного давления способно вызвать серьёзные патологические изменения в организме человека [1]. Вместе с тем в мировой научной литературе встречаются экспериментальные данные, утверждающие о том, что в отличие от длительной внутрибрюшной гипертензии кратковременное увеличение внутрибрюшного давления имеет положительные эффекты и может использоваться при профилактике заболеваний межпозвонковых дисков поясничного отдела позвоночного столба.
Влияние внутрибрюшного давления на состояние поясничного отдела позвоночника
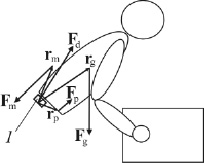
Предположение о том, что внутрибрюшное давление уменьшает компрессию позвонков поясничного отдела, было сделано ещё в 1923 году [16]. В 1957 году Bartelink теоретически обосновал эту гипотезу, используя законы классической механики [6]. Bartelink, а в последствии и Morris с соавторами [20] предположили, что внутрибрюшное давление реализуется в полости живота в виде силы (реакции), действующей со стороны диафрагмы таза. При этом для свободного (незакреплённого) тела (рис. 3) законы статики записываются в следующей математической форме [9]:
rg×Fg + rm×Fm + rp×Fp = 0, (2)
где Fg – сила тяжести, действующая на туловище; Fm – усилие со стороны m. erector spinae; Fd – нагрузка на пояснично-крестцовый межпозвонковый диск; Fp – усилие от внутрибрюшного давления; rg, rm и rp – радиус-векторы, проведённые из точки приложения силы Fd в точки приложения сил Fg, Fm и Fp, соответственно. Сумма моментов сил в уравнении (2) определяется относительно центра пояснично-крестцового межпозвонкового диска.
Рис. 3. Схема свободного тела в состоянии удержания тяжести. Цифрой «1» обозначен пятый позвонок поясничного отдела.
Из рис. 3, а также формулы (2) видно, что для сохранения равновесия при действии сгибающего момента со стороны силы тяжести (относительно центра пояснично-крестцового межпозвонкового диска), разгибатели спины, сокращаясь, создают разгибающий момент Mm (на рис. 3 не показан). Поэтому, чем больше величина сгибающего момента от силы Fg, тем большее усилие необходимо развить m. erector spinae и тем большая нагрузка приходится на межпозвонковый диск. При наличии внутрибрюшного давления возникает сила Fp и дополнительный разгибающий момент Mp (на рис. 3 не показан), определяемый третьим слагаемым в уравнении (2). Таким образом, внутрибрюшное давление способствует снижению величины силы Fm, необходимой для поддержания равновесия туловища с тяжестью в руках и, следовательно, приводит к уменьшению нагрузки на рассматриваемый межпозвонковый диск.
Результаты экспериментов in vivo, полученные в работе [13], подтвердили наличие дополнительного момента Mp. Однако величина этого момента не превысила 3 % от максимального значения Mm. Это означает, что роль внутрибрюшного давления в качестве дополнительного разгибателя туловища является недостаточно существенной. Тем не менее любое уменьшение нагрузки на поясничный отдел позвоночника со стороны мышцы, выпрямляющей позвоночник, может предостеречь от потенциального повреждения позвоночных элементов [11].
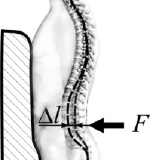
Более значимым является влияние внутрибрюшного давления на жёсткость поясничного отдела позвоночного столба. При этом под жёсткостью k понимается следующее отношение:
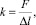
где F – сила, прикладываемая к той точке на спине, которая соответствует положению исследуемого поясничного позвонка; Δl – соответствующее перемещение этой точки (рис. 4). Измерения in vivo показали, что увеличение жёсткости k на уровне четвёртого поясничного позвонка при наличии давления внутри полости живота может достигать 31 % [14]. При этом все наблюдения производились в отсутствии активности мышц передней, боковой и задней частей оболочки брюшной полости (в т.ч. m.erector spinae), что является немаловажным, так как некоторые авторы связывают повышение жёсткости поясничного отдела позвоночного столба с увеличением жёсткости всей оболочки брюшной полости за счёт напряжения её мышц [7, 19].
Рис. 4. Определение жёсткости поясничной части позвоночника
Таким образом, внутрибрюшное давление способствует уменьшению деформаций в поясничной области позвоночника под действием внешних сил, что, в свою очередь, понижает вероятность патологических явлений, возникающих в процессе поднятия тяжестей.
Биомеханический подход к исследованию влияния внутрибрюшного давления на поясничный отдел позвоночного столба
Механизм влияния внутрибрюшного давления на состояние поясничного отдела позвоночного столба, безусловно, до конца не изучен. Данная проблема является сложной и носит междисциплинарный характер, так как требует знаний специалистов различного профиля. Одним из важнейших направлений междисциплинарного подхода к исследованию представленной взаимосвязи является биомеханическое моделирование. Использование современных компьютерных технологий и вычислительных алгоритмов для определения количественных закономерностей взаимодействия внутрибрюшного содержимого и элементов поясничной области позвоночника позволит разработать определяющие соотношения, учитывающие помимо всего прочего индивидуальные особенности. Этим объясняется необходимость изучения рассматриваемой проблемы с точки зрения биомеханики.
Внутрибрюшное давление является сложным физиологическим параметром. Наряду с негативным влиянием на органы и системы человеческого организма давление в полости живота, кратковременно увеличиваемое в процессе поднятия тяжестей, может предотвратить травмы поясничного отдела позвоночного столба. Вместе с тем взаимосвязь между внутрибрюшным давлением и состоянием поясничного отдела позвоночника является малоизученной. Поэтому междисциплинарные исследования, направленные на установление количественных зависимостей описываемого явления, являются необходимыми с точки зрения разработки профилактических мероприятий по снижению травматичности поясничных элементов позвоночника.
Рецензенты:
Акулич Ю.В., д.ф.-м.н., профессор кафедры теоретической механики, ФГБОУ ВПО «Пермский национальный исследовательский политехнический университет», г. Пермь;
Гуляева И.Л., д.м.н., заведующая кафедрой патологической физиологии, ГБОУ ВПО «Пермская государственная медицинская академия им. акад. Е.А. Вагнера» Минздрава РФ, г. Пермь.
Синдром абдоминальной гипертензии: состояние проблемы
Ключевые слова: мониторинг внутрибрюшного давления, синдром интраабдоминальной гипертензии, декомпрессивная лапаростомия
Abdominal compartmenf syndrome is a potentially lethal condition caused by any event that produces intra-abdominal hypertension. The history, pathophysiology, rational intraabdominal pressure monitoring, clinical presentation, and management of this complication is outlined in this rewiew. Estimation of intra-abdominal pressure by urinary bladder pressure measurement is as «gold standard» in IAP monitoring. Intensive care and surgical management consists of urgent decom-pressive laparotomy.
Key Words: intraabdominal pressure monitoring, abdominal compartment syndrome, decompressive laparotomy
Впервые проблему интраабдоминальной гипертензии стали изучать в XIX столетии, когда Магеу и Burt обратили внимание на прямую зависимость выраженности дыхательной недостаточности от напряжённости передней брюшной стенки. В настоящее время существует большое количество как экспериментальных, так и клинических исследований, посвященных негативному влиянию интраабдоминальной гипертензии (ИАГ) на функцию различных органов и систем. Уже доказано, что прогрессирование ИАГ значительно увеличивает летальность пациентов в критическом состоянии [1, 2, 4, 6, 7].
Регулярно появляются новые методы измерения и мониторинга внутрибрюшного давления (ВБД). Однако точность и результативность этих методов сильно варьируют [1,2,4-9].
Следовательно, сильно различаются пороговые значения ВБД, которые определяют ИАГ и синдром ИАГ (СИАГ). Некоторые авторы используют термины ИАГ и СИАГ поочерёдно, заменяя друг друга, формулируя неправильные понятия и определения, получая абсурдные результаты, оценивать которые достаточно сложно, а порой и невозможно 13, поэтому данная непростая проблема остаётся актуальной и сегодня.
По результатам опроса, проведенного Европейским советом по интенсивной терапии (ESICM) и Советом по терапии критических состояний (SCCM), в котором участвовало более 1300 респондентов, 13,6% до сих пор незнакомы с термином ИАГ и представления не имеют о негативном влиянии повышенного ВБД. Около 69,2% респондентов верят в то, что для диагностики ИАГ достаточно лишь клинического осмотра пациента с мониторингом ВБД, а 24,1% используют лишь последнее. Другими методами диагностики, по результатам опроса, оказались: КТ брюшной полости (13,1%); измерение периметра передней брюшной стенки (10,1 %) и УЗ И органов брюшной полости (7,8%). Измерение ВБД через мочевой пузырь является самым широко используемым (92,3%), за ним следует прямой метод (4,2%) и измерение в желудке (2,8%). При использовании мочевого пузыря для измерения ВБД 52,8% респондентов вливают 50 мл, 21,9% — 100 мл, а у 4,3% респондентов — до 200 мл! Тогда как всего 16,2%, вводят менее 25 мл жидкости, что соответствует рекомендациям Всемирного общества по СИАГ (WSACS) [14]. Об абдоминально-перфузионном давлении (АПД) знают около 81,5% респондентов, о фильтрационном градиенте—19,7%. Что касается нормальных величин, то 14,8% опрошенных верят в то, что уровень ВБД в норме составляет примерно 10 мм рт. ст., 77,1 % определяют интраабдоминальную гипертензию на уровне 15 мм рт. ст., а СИАГ — на уровне 25 мм рт. ст. (58, 0 %).
Учитывая существующие разногласия в определении СИАГ и его ведении, в 2004 г. была организована первая согласительная конференция, посвященная проблемам СИАГ.
Основываясь на результаты международных многоцентровых исследований, были сформулированы определения синдрома и патологических состояний, связанных с ним, а также алгоритм инструментального обследования пациента и разработаны рекомендации по профилактике и лечению (табл. 1) [14].
ВБД: внутрибрюшное давление; САД: среднее артериальное давление; АПД: абдоминально-перфузионное давление; ИАГ: интраабдоминальная гипертензия; СИАГ: синдром интраабдоминальной гипертензии; ФГ: фильтрационный градиент; ГФД: гломерулярно-фильтрационное давление; ПДПК: проксимальное давление в почечных канальцах.
Внутрибрюшное давление (ВБД)
Абдоминально-перфузионное давление (АПД)
Фильтрационный градиент
Нормальные и патологические величины внутрибрюшного давления
Таблица 1. Определения ИАГ и СИАГ [14]
ВБД — это установившееся давление в брюшной полости
ВБД необходимо выражать в мм рт. ст. и измерять в горизонтальном положении пациента на спине в конце выдоха при отсутствии мышечного напряжения передней брюшной стенки. Нулевое значение шкал следует устанавливать на уровне среднеподмышечной линии
При измерении ВБД через мочевой пузырь рекомендуется вводить не более 25 мл тёплого стерильного физиологического раствора
В норме уровень ВБД у взрослых пациентов составляет 5-7 мм рт. ст.
ИАГ — это постоянно или периодически (но не кратковременно) регистрируемое патологическое повышение ВБД > 12 мм рт. ст.
Первичный СИАГ — это состояние, связанное с повреждением либо заболеванием органов брюшной полости, которое зачастую требует экстренного/срочного хирургического или рентгенохирургического вмешательства
Вторичный СИАГ относится к патологическим состояниям, которые берут начало вне брюшной полости
Интраабдоминальная гипертензия (ИАГ)
Точный уровень ВБД, который характеризуется как ИАГ до сих пор остаётся предметом дебатов. Ранее в литературе доминировал интервал 15-18 мм рт. ст. (20-25 мм вод. ст.). Burch и соавт. в 1996 г. разработали классификацию ИАГ для регулирования её комплексного лечения, которая после некоторых незначительных изменений в настоящее время имеет следующий вид: I степень характеризуется внутрипузырным давлением от 12 до 15 мм рт. ст., II степень — 16-20 мм рт. ст., III степень — 21-25 мм рт. ст., IV степень — более 25 мм рт. ст. [14]. Очевидно, что патологическое повышение ВБД есть переход от редких его скачков без каких либо клинических проявлений до стойкого повышения с негативным влиянием на функцию органов и систем. В то же время выделять лишь цифры ВБД как единственный параметр, характеризующий ИАГ, по мнению многих авторов, не совсем правильно. Однако решение этого вопроса пока остаётся в будущем.
В настоящее время в литературе пороговые значения ИАГ (максимальные и средние цифры ИАГ) варьируют от 12 до 15 мм рт. ст. [2, 3, 11, 20-29]. Некоторые работы описывают негативное влияние ВБД уже при менее чем 10 либо 15 мм рт. ст. [16, 18, 30-33]. Недавнее, до сих пор единственное в своём роде, многоцентровое исследование, направленное на установление распространённости (частоты), этиологии и предрасполагающих факторов развития ИАГ у смешанных популяций (групп) пациентов интенсивной терапии, показало, что уровень ВБГ, определяющего ИАГ, составляет 12 мм рт. ст. и выше [6].
В 2004 г. на конференции WSACS интраабдоминальная гипертензия была определена следующим образом: это устойчивое повышение ВБД до 12 мм рт. ст. и более, которое регистрируется как минимум при трёх стандартных измерениях с интервалом в 4-6 ч [14]. Это определение исключает регистрацию коротких, непродолжительных колебаний ВБД, не имеющих никакого клинического значения.
Синдром интраабдоминальной гипертензии
Измерение внутрибрюшного давления
Непосредственно в брюшной полости давление можно измерять при лапароскопии, перитонеальном диализе либо при наличии лапаростомы (прямой метод). На сегодняшний день прямой метод считается наиболее точным, однако его использование ограничено из-за высокой стоимости. Как альтернатива описаны непрямые методы мониторинга ВБД, которые подразумевают использование соседних органов, граничащих с брюшной полостью: мочевой пузырь, желудок, матка, прямая кишка, нижняя полая вена.
В настоящее время «золотым стандартом» непрямого измерения ВБД является использование мочевого пузыря [9]. Эластичная и хорошо растяжимая стенка мочевого пузыря при объёме, не превышающем 25 мл, выполняет функцию пассивной мембраны и точно передаёт давление брюшной полости. Первым этот способ предложили Kron и соавт. в 1984 г. Для измерения он использовал обычный мочевой катетер Фолея, через который в полость мочевого пузыря вводил 50-100 мл стерильного физиологического раствора, после чего присоединял к катетеру Фолея прозрачный капилляр либо линейку и измерял внутрипузырное давление, принимая за ноль лонное сочленение. Однако используя этот метод, приходилось при каждом измерении собирать систему заново, что предполагало высокий риск развития восходящей инфекции мочевыводящих путей.
В настоящее время разработаны специальные закрытые системы для измерения внутрипузырного давления. Некоторые из них подключаются к датчику инвазивного давления и монитору (AbVizer™), другие являются полностью готовыми к использованию без дополнительных инструментальных аксессуаров (Unometer™Abdo-Pressure™, Unomedical). Последние считаются более предпочтительными, так как намного проще в использовании и не требуют дополнительной дорогостоящей аппаратуры. Unometer™Abdo-Pressure™ представляет стерильную закрытую систему, включающую уриметр последнего поколения, и измерительную часть, состоящую из градуированной трубки с шагом измерения 1 мм рт. ст. и встроенного в её верхнюю часть гидрофобного антибактериального воздушного фильтра, через который в момент измерения ВБД в систему проходит очищенный воздух.
Основная цель создания такой системы — обеспечить многократное измерение ВБД при помощи простейшей, легко выполнимой манипуляции, точный мониторинг мочевыделительной функции почек и эффективное предупреждение восходящего инфицирования мочевыводящих путей.
Метод измерения ВБД аналогичен предложенному Kron, однако конструктивные особенности системы исключают необходимость её разъединения, сохраняя её закрытой в процессе повторных измерений ВБД, что представляется важным с точки зрения предупреждения инфекционных осложнений у больных тяжёлой категории.
При измерении внутрипузырного давления не последнюю роль играет скорость введения физиологического раствора и его температура. Так как быстрое введение холодного раствора может привести к рефлекторному сокращению мочевого пузыря и завышению уровня внутрипузырного, а следовательно, и ВБД. Пациент при этом должен находиться в положении лёжа на спине, на горизонтальной поверхности. Более того, адекватное обезболивание больного в послеоперационном периоде за счёт расслабления мышц передней брюшной стенки позволяет получить наиболее точные цифры ВБД [6, 8].
До недавнего времени одной из нерешённых проблем оставалось точное количество вводимой жидкости в мочевой пузырь, необходимой для измерения ВБД. Сегодня эти цифры варьируют от 10 до 200 мл. Этому вопросу было посвящено немало международных исследований, по результатам которых было доказано, что введение около 25 мл не приводит к искажению уровня ВБД, что было утверждено на согласительной комиссии по проблеме СИАГ в 2004 г. [14].
Противопоказанием к применению этого метода является повреждение мочевого пузыря или сдавление гематомой или опухолью. В такой ситуации ИАГ оценивают, измеряя внутрижелудочное давление [8].
Профилактика развития интраабдоминальной гипертензии
Наиболее важным является профилактика и ранняя диагностика ИАГ ещё до начала развития полиорганной недостаточности, которые возможны в условиях постоянного мониторинга ИАГ у пациентов группы риска развития СИАГ.
С целью профилактики ИАГ пациентам с черепно-мозговой травмой и тупой травмой живота при наличии психомоторного возбуждения в острый период необходимо применение седативных препаратов. Своевременная стимуляция нарушенной моторной функции желудочно-кишечного тракта после лапаротомии и/или травмы живота также способствует снижению ИАГ.
Этапное хирургическое лечение распространённого перитонита (Декомпрессионная лапаротомия / релапаротомия)
В настоящее время хирургическая декомпрессия является единственным эффективным методом лечения СИАГ. Она достоверно снижает летальность, и по жизненным показаниям выполняется даже в палате интенсивной терапии [3,5, 16, 83]. Без проведения хирургической декомпрессии — радикального лечения СИАГ летальность достигает 100%.
При декомпрессионной лапаротомии/релапаротомии, произведённой спустя 3-6 ч от появления первых признаков СИАГ, летальность составляет около 20%, в более поздние сроки — от 43 до 65,5%.
После выполнения лапаротомии/ релапаротомии решается вопрос о типе ушивания передней брюшной стенки [3]. Мы попытались осветить проблему хирургического лечения больных с распространенным гнойным перитонитом, а в частности этапного хирургического лечения, при котором возможно ведение лапаротомной раны в условиях декомпрессионного диастаза ее краев.
Наиболее популярным вариантом является сведение краёв раны при помощи вентрофил (B.Braun-Dexon GmbH). Вентрофилы фиксируются к брюшной стенке отдельными узловыми швами через все слои, на расстоянии 4-5 см от края раны. Дозированное сведение краёв осуществляется лавсановыми шнурами, проведёнными через вентрофилы. Реже применяют застежки типа «молния» и «репейник» (Velcro) с их фиксацией непрерывным лавсановым швом к краям апоневроза, реже — к кожным краям раны. Опыт применения этих и других сближающих устройств на протяжении последних двадцати лет вызвал некоторые разочарования, связанные с высокой травматичностью, сложностью и ненадёжностью этих методов фиксации.
В связи с этим последние годы дозированное сведение краёв лапаротомной раны при этапном лечении перитонита, панкреонекроза и острых окклюзии мезентериальных сосудов мы выполняем отдельными узловыми лавсановыми швами или проленом. Швы проводят через все слои передней брюшной стенки на расстоянии 3-5 см от края раны и 7-8 см друг от друга. В целях дозированной декомпрессии брюшной полости швы затягивают без натяжения. При последующих операциях швы следует проводить в новых местах. Несмотря на, казалось бы, большую травматизацию тканей, этот способ практически не вызывает гнойно-некротических поражений брюшной стенки даже на фоне 7-9 этапных вмешательств.
Абсолютные показания к открытому ведению брюшной полости (лапаростома в буквальном значении этого термина) устанавливают при признаках анаэробного инфицирования брюшной полости или забрюшинного пространства, а также при невозможности свести края лапаротомии, либо в результате выраженного гнойно-некротического поражения раны или флегмоны передней брюшной стенки, либо в результате прогрессирующего СИАГ. Для предупреждения эвентрации в этих случаях используют бандаж. Края раны сближают при помощи лейкопластыря, предварительно укрывая петли кишечника синтетической пленкой и выполняя полость раны тампонами с левомеколем.
Таким образом, при небольшом числе планируемых этапных вмешательств (не более 4) и отсутствии гнойного поражения лапаротомной раны к началу этапного лечения любой метод фиксации краёв раны, имея свои преимущества и недостатки, обеспечивает позитивные результаты и не ведёт к возникновению тяжёлых осложнений. Разница заключается, пожалуй, лишь в стоимости применяемых устройств. С увеличением числа этапных операций, т.е. в зависимости от интенсивности и длительности эксплуатации тех или иных устройств и методов, угроза раневых осложнений возрастает, при этом их характер и тяжесть имеет особенности, связанные с типом применяемых устройств и методов ведения лапаростомы. Однако общий для всех способов механизм повреждения — ишемия и инфицирование тканей брюшной стенки — остаётся неизменен. В целом преимущества и возможные недостатки основных технологий ведения лапаростомы, с точки зрения риска раневых осложнений и ожидаемого эффекта лечения перитонита — дренажной и декомпрессионной функции лапаростомы, можно заключить в следующем:
1. Применение стационарно закрепляемых устройств
Преимущества — отсутствие повторной острой травмы брюшной стенки при сведении и разведении краёв раны. Равномерная тракция всех слоев брюшной стенки. Возможность дозированной абдоминальной декомпрессии.
Недостатки — потеря функции при прорезывании даже одного шва. Ишемические повреждения тканей брюшной стенки, инфицирование тканей и анатомических пространств в зоне фиксации. Типичные осложнения, связанные со способом фиксации — ишемический или гнойно-деструктивный некроз тканей в зоне фиксации приспособлений: некроз кожи и подкожной клетчатки, некроз прямых мышц живота, флегмона влагалища прямых мышц (вентрофилы, уголки), распространённый краевой некроз и прорезывание швов апоневроза, невозможность применения при гнойно-деструктивных раневых осложнениях (молния, velkro). Только кожная тракция (швы, спицы, Bogota bag) — нарастающий диастаз мышечно-апоневротического слоя раны вследствие некорригируемой тракции косых и поперечных мышц живота.
2. Применение временных (одноразовых) устройств
Преимущества — быстро, просто, дёшево, отсутствие распространённых ишемических повреждений тканей в зоне фиксации. Возможность дозированной интраабдоминальной декомпрессии.
Недостатки — повторная острая травма и инфицирование тканей брюшной стенки, стандартное осложнение — локальное нагноение по ходу прокола брюшной стенки, увеличение интервала между санациями или отказ от смены швов и места их проведения, т.е. длительное использование одних и тех же швов, которые распускают и вновь затягивают при каждой санации, заметно увеличивает риск нагноения.
3. Отсутствие фиксации краев — открытая лапаростома
Преимущества — лучшие условия для раны — отсутствие повторной травмы, идеальный дренаж. Отсутствие ИАГ.
Недостатки — не физиологично, преобладание тяжёлых интраабдоминальных осложнений (кишечные свищи) над раневыми. Трудности реконструкции брюшной стенки, обусловленные большим диастазом мышечно-апоневротического слоя вследствие не компенсируемой тракции косых и поперечных мышц живота.
При завершении режима этапного лечения и заключительной хирургической обработке раны идеальным является послойное восстановление целостности брюшной стенки (чередование 8-образных и узловых швов апоневроза + редкие кожные швы по Донатти). Применение дополнительных швов (узловые или 8-образные швы через все слои брюшной стенки с протекторами из силиконовых трубок или салфеток) с целью уменьшения натяжения и сближения краёв раны вряд ли рационально из-за усугубления ишемии тканей и, как следствие, последующих некробиотических изменений брюшной стенки.
Назоинтестинальная интубация
Необходимость кишечной декомпрессии и детоксикации как важнейшего этапа практически любой релапаротомии не вызывает сомнений. Предпочтительным считается вариант использования интестинальных зондов различных конструкций. Применение разгрузочных стом, накладываемых для декомпрессии желудочно-кишечного тракта в условиях распространённого перитонита, подвергается резкой критике и считается нежелательным.
Объективно удостовериться в правильном положении зонда, т.е. в возможности его при данной ситуации (состояние кишечника, характеристики самого зонда) исполнять свои последующие ожидаемые функции можно только интраоперационно, поэтому при перитоните контроль эффективности эвакуации содержимого и лаваж кишечника
следует начинать сразу после окончательной установки зонда (равномерное заполнение кишки при введении и свободная эвакуация) и контролировать при каждой санации в случае этапного лечения.
Учитывая преимущественное значение энтерального источника инфицирования и интоксикации у больных перитонитом в стадии полиорганной недостаточности, интубация кишки предполагает использование всего комплекса средств энтеральной детоксикации, деконтаминации и энтеросорбции.
В послеоперационном периоде «работу» зонда крайне сложно контролировать и моделировать. Адекватное исполнение функций интестинального зонда в послеоперационном периоде требует постоянного ухода (промывание) и коррекции положения (смещение), особенно при необходимости длительной интубации.
Противопоказания к выполнению назоинтестинальной интубации
Необходимость выполнения УЗИ брюшной полости непосредственно перед этапными операциями, или интраоперационно, особенно после 3—4-ой санации брюшной полости, когда адгезивный процесс при позитивном течении перитонита (регрессии) достигает максимума. Метод обеспечивает топическую диагностику интраабдоминальных скоплений жидкости и оценку состояния тонкой кишки (выраженность пареза, адекватность интестинального дренирования). Позволяет уменьшить объём ненужной операционной травмы, связанной с необходимостью тотального разделения сращений (конгломерата петель кишечника и сальника), и, ориентируясь на результаты исследования, проводить ревизию межпетлевых пространств целенаправленно и дозированно, с минимальной травмой.
Исследования показывают, что во время выполненная декомпрессия достаточно быстро приводит к нормализации гемодинамики и дыхания [4, 5]. Возможные осложнения декомпрессии — это гипотония вследствие перераспределения объёма циркулирующей крови, асистолия, связанная с реперфузией и попаданием в кровоток промежуточных продуктов метаболизма, а также тромбоэмболия лёгочной артерии, обусловленная высоким риском тромбообразования у пациентов с СИАГ [6, 18].
Лечение больных с синдромом интраабдоминальной гипертензии
В условиях развившегося СИАГ пациенты, бесспорно, нуждаются в проведении искусственной вентиляции лёгких (ИВЛ). Незнание патофизиологии нарушения дыхания в условиях компрессии и, соответственно, неправильно подобранные параметры ИВЛ не только не устраняют, но и усугубляют дыхательную недостаточность. Респираторную поддержку следует проводить согласно концепции протективной вентиляции с целью предотвращения вентилятор-ассоциированного повреждения лёгких. Обязателен подбор оптимального положительного давления конца выдоха (PEEP) с целью увеличения функционально активных альвеол за счет колабированных базальных сегментов. Недостаточный уровень PEEP не предотвращает колабирования альвеол на выдохе вследствие высокого стояния купола диафрагмы, способствуя развитию ателектотравмы. Чрезмерно высокий уровень PEEP усугубляет гемодинамические нарушения в связи с ростом внутригрудного давления, поэтому его следует подбирать согласно графику «давление — объем» [6,7]. В условиях ИАГ снижается прежде всего комплаенс грудной стенки, а не лёгких, поэтому оптимально использование малых дыхательных объёмов (5-6 мл/кг) с целью предотвращения баро- и волюмотравмы [4, 86, 87]. Инспираторная фракция кислорода должна быть минимально достаточной для нормализации сатурации смешанной венозной крови. Снижение последней может быть связано и с уменьшением,доставки кислорода в условиях нарушения гемодинамики.
Применение агрессивных параметров ИВЛ на фоне СИАГ может повлечь за собой развитие острого респираторного дистресс-синдрома (ОРДС).
Инфузионная терапия
Наличие и степень выраженности гиповолемии у пациентов с ИАГ обычными методами установить практически невозможно, поэтому инфузия должна проводиться с осторожностью, с учётом возможного отёка ишемизированного кишечника и ещё большего повышения интраабдоминального давления [4, 88]. При подготовке больного к хирургической декомпрессии с целью предупреждения гиповолемии рекомендуется инфузия кристаллоидов.
Восстановление темпа мочеотделения в отличие от гемодинами-ческих и респираторных нарушений даже после декомпрессии наступает не сразу, и для этого может потребоваться довольно длительное время [6]. В этот период целесообразно использование экстракорпоральных методов детоксикации с учётом мониторинга электролитов, мочевины и креатинина.