Что выполняет регуляторную функцию
Регуляторная функция белков
Регуляторная функция белков ― осуществление белками регуляции процессов в клетке или в организме, что связано с их способностью к приёму и передаче информации. Действие регуляторных белков обратимо и, как правило, требует присутствия лиганда. Постоянно открывают всё новые и новые регуляторные белки, в настоящее время известна, вероятно, только малая их часть.
Существует несколько разновидностей белков, выполняющих регуляторную функцию:
Содержание
Белки, участвующие в межклеточной сигнализации
Белки-гормоны (и другие белки, участвующие в межклеточной сигнализации) оказывают влияние на обмен веществ и другие физиологические процессы.
Гормоны — вещества, которые образуются в железах внутренней секреции, переносятся кровью и несут информационный сигнал. Гормоны распространяются безадресно и действуют только на те клетки, которые имеют подходящие белки-рецепторы. Гормоны связываются со специфическими рецепторами. Обычно гормоны регулируют медленных процессы, например, рост отдельных тканей и развитие организма, однако есть и исключения: например, адреналин (см. статью адреналин) — гормон стресса, производное аминокислот. Он выделяется при воздействии нервного импульса на мозговой слой надпочечников.При этом начинает чаще биться сердце, повышается кровяное давление и наступают другие ответные реакции. Также он действует на печень(расщепляет гликоген). Глюкоза выделяется в кровь, и ее используют мозг и мышцы как источник энергии.
Белки-рецепторы
К белкам с регуляторной функцией можно отнести также белки-рецепторы. Мембранные белки — рецепторы передают сигнал с поверхности клетки внутрь, преобразовывая его. Они регулируют функции клеток за счет связывания с лигандом, который «сел» на этот рецептор снаружи клетки; в результате активируется другой белок внутри клетки.
Большинство гормонов действуют на клетку, только если на ее мембране есть определенный рецептор — другой белок или гликопротеид. Например, β2- адренорецептор находится на мембране клеток печени. При стрессе молекула адреналина связывается с β2- адренорецептором и активирует его. Далее активированный рецептор активирует G-белок, который присоединяет ГТФ. После многих промежуточных этапов передачи сигнала происходит фосфоролиз гликогена. Рецептор осуществил самую первую операцию по передаче сигнала, ведущего к расщеплению гликогена. Без него не было бы последующих реакций внутри клетки.
Внутриклеточные регуляторные белки
Белки регулируют процессы, происходящие внутри клеток, при помощи нескольких механизмов:
Белки-регуляторы транскрипции
Транскрипционный фактор — это белок, который, попадая в ядро, регулирует транскрипцию ДНК, то есть считывание информации с ДНК на мРНК (синтез мРНК по матрице ДНК). Некоторые транскрипционные факторы изменяют структуру хроматина, делая его более доступным для РНК-полимераз. Существуют различные вспомогательные транскрипционные факторы, которые создают нужную конформацию ДНК для последующего действия других транскрипционных факторов. Еще одна группа транскрипционных факторов — это те факторы, которые не связываются непосредственно с молекулами ДНК, а объединяются в более сложные комплексы с помощью белок-белковых взаимодействий.
Факторы регуляции трансляции
Трансляция — синтез полипептидных цепей белков по матрице мРНК, выполняемый рибосомами. Регуляция трансляции может осуществляться несколькими способами, в том числе и с помощью белков-репрессоров, которые, связываются с мРНК. Известно много случаев, когда репрессором является белок, который кодируется этой мРНК. В этом случае происходит регуляция по типу обратной связи (примером этого может служить репрессия синтеза фермента треонил-тРНК-синтетазы).
Факторы регуляции сплайсинга
Внутри генов эукариот есть участки, не кодирующие аминокислот. Эти участки называются интронами. Они сначала переписываются на пре-мРНК при транскрипции, но затем вырезаются особым ферментом. Этот процесс удаления интронов, а затем последующее сшивание концов оставшихся участков называют сплайсингом (сшивание, сращивание). Сплайсинг осуществляется с помощью небольших РНК, обычно связанных с белками, которые называются факторами регуляции сплайсинга. В сплайсинге принимают участие белки, обладающие ферментативной активностью. Они придают пре-мРНК нужную конформацию. Для сборки комплекса(сплайсосомы) необходимо потребление энергии в виде расщепляемых молекул АТФ, поэтому в составе этого комплекса есть белки, обладающие АТФ-азной активностью.
Существует альтернативный сплайсинг. Особенности сплайсинга определяются белками, способными связываться с молекулой РНК в областях интронов или участках на границе экзон-интрон. Эти белки могут препятствовать удалению одних интронов и в то же время способствовать вырезанию других. Направленная регуляция сплайсинга может иметь значительные биологические последствия. Например, у плодовой мушки дрозофилы альтернативный сплайсинг лежит в основе механизма определения пола.
Протеинкиназы и протеинфосфатазы
Важнейшую роль в регуляции внутриклеточных процессов играют протеинкиназы — ферменты, которые активируют или подавляют активность других белков путем присоединения к ним фосфатных групп.
Протеинкиназы регулируют активность других белков путем фосфолирования — присоединения остатков фосфорной кислоты к остаткам аминокислот, имеющих гидроксильные группы. При фосфорилировании обычно изменяется функционирование данного белка, например, ферментативная активность, а также положение белка в клетке.
Существуют также протеинфосфатазы — белки, которые отщепляют фосфатные группы. Протеинкиназы и протеинфосфатазы регулируют обмен веществ, а также передачу сигналов внутри клетки. Фосфорилирование и дефосфорилирования белков — один из главным механизмов регуляции большинства внутриклеточных процессов.
Что выполняет регуляторную функцию
• Небольшие белки, связывающиеся с ГТФ, активны, когда связаны с ГТФ и неактивны при связывании с ГДФ
• Активация ускоряется под действием GEF (фактора обмена гуаниловых нуклеотидов), который является катализатором обмена ГДФ/ГТФ
• GAP ускоряет гидролиз и инактивацию
• Ингибиторы диссоциации ГДФ (GDI) замедляют спонтанный обмен нулеотидов
ГТФ-связывающие белки, обладающие мономерной структурой, у млекопитающих кодируются примерно 150 генами. Они модулируют самые разнообразные внутриклеточные процессы, включая передачу сигнала, перемещение органелл и транспорт в них метаболитов, сборку цитоскелета и морфогенез. К числу небольших ГТФ-связывающих белков, участвующих в системах передачи сигналов, относятся Ras и родственные белки (Ral, Rap), а также Rho/Rac/Cdc42. Общее их количество достигает 10-15 белков. Их размер обычно составляет 20-25 кДа, и они гомологичны ГТФ-связывающим доменам субъединиц Ga.
Регуляторные свойства небольших ГТФ-связывающих белков находятся под контролем ГТФ и цикла гидролиза, так же как это имеет место для гетеротримеров G-белков, проявляющих аналогичные регуляторные функции. Они активируются под действием ГТФ, и гидролиз связанного ГТФ до ГДФ приводит к их инактивации. Катализаторы обмена ГДФ/ГТФ, известные как GEF (факторы обмена гуаниловых нуклеотидов, функционально аналогичные GPCR), способствуют активации, и белки GAP ускоряют гидролиз и последующую инактивацию. Наряду с этим, ингибиторы диссоциации ГДФ (GDI) замедляют спонтанный обмен нуклеотидов и активацию, что снижает базальную активность, свойственную субъединицам Gβγ гетеротримеров G-белков.
Хотя основные регуляторные элементы для мономеров и гетеротримеров G-белков одинаковы, мономерные белки дополнительно используют основной ГТФазный цикл. Считается, что выходной сигнал гетеротримеров G-белков и многих их мономеров обычно отражает состояние равновесия между их активным (связанным с ГТФ) и неактивным (связанным с ГДФ) состоянием, которое существует в быстро оборачивающемся ГТФазном цикле. GEF способствуют образованию более активного G-белка, a GAP, его неактивному состоянию. Напротив, примерно одинаковое количество мономеров G-белков функционируют в качестве переключателей. Они начинают выполнять свои функции (регуляцию, мобилизацию других белков) после связывания ГТФ. Затем, в течение многих секунд или минут, они сохраняют свою активность до тех пор, пока на них не подействуют GAP.

Три распространенных эффектора включают Raf, PI 3-киназу и RaIGDS.
При активации этих эффекторов активируются процессы с участием МАРК,
увеличивается активность PI 3-киназы и сборка белкового комплекса, участвующего в экзоцитозе секреторных везикул.
Цитоплазматический комплекс Ran-ГДФ отщепляется от экспортирующих кариоферинов, что облегчет диссоциацию выходящего карго, и от импортирующих кариоферинов, тем самым позволяя предназначенному на импорт карго связаться с ними. Таким образом, для таких мономерных G-белков, как Ran, каждая фаза ГТФазного цикла определяет специфический сопряженный этап в параллельном регуляторном цикле.
Следующее основное различие между мономерами и гетеротримерами G-белков касается структуры GEF, GAP, и GDI. Как GEF, так и GAP для мономеров ГТФ-связывающих белков гетерогенны по своей структуре (хотя существуют отдельные структурно близкие семейства). Вместе с тем, механизмы, регулирующие эти GEF и GAP, различны. Они включают фосфорилирование протеин-киназами, аллостерическую регуляцию гетеротримерами и/или мономерами G-белков, вторичными мессенджерами и другими регуляторными белками; особенности субклеточной локализации или мобилизации на каркасных структурах, а также другие механизмы.
Белки Ras представляют собой первые из обнаруженных небольших ГТФ-связывающих белков. Они были идентифицированы как продукты онкогенов, поскольку при гиперэкспрессии или при постоянной активации за счет мутации вызывают злокачественный рост. Они относятся к числу наиболее часто мутирующих генов в опухолях человека. Некоторые вирусные ras гены представляют собой хорошо известные онкогены.
В клетках млекопитающих присутствуют три гена ras (Н, N и К). Они в различной степени могут участвовать в формировании реакций на входе и выходе и заменять друг друга в некоторых генетических проявлениях. Отдельным Ras белкам трудно приписать уникальные функции. С участием Ras белков на входе происходит много различных процессов, что свидетельствует об их роли в качестве критических узлов цепей передачи сигналов.
Регуляция активности Ras GEF и GAPS осуществляется посредством Туг киназ рецепторного и нерецепторного происхождения, за счет прямого фосфорилирования и мобилизации регуляторов на плазматической мембране. В активации Ras также принимают участие другие серин/треонин киназы цитоплазматического происхождения. Еще один представитель семейства Ras, Rap1, также участвует в активации, поскольку предполагается, что он конкурирует с белками Ras за мишени протеинкиназ; in vivo он может подавлять онкогенную активность Ras. Однако, Rapl регулируется независимо и также влияет на независимые пути передачи сигналов.
Например, один из его GAP стимулируется представителями Gi группы G-белков, а несколько GEF активируются Са2+, диацилглицерином и цАМФ.
Белки Ras обычно регулируют рост, пролиферацию и дифференцировку клеток, модулируя активность многих эффекторных белков. К числу наиболее известных и хорошо изученных эффекторов Ras относится протеинкиназа Raf, запускающая МАРК каскад. На рисунке ниже представлены некоторые из эффекторов Ras.
Rho, Rac и Cdc42 представляют собой родственные ГТФ-связывающие белки, обладающие мономерной структурой, которые участвуют в формировании сигналов, влияющих на морфологию клеток Каждый класс белков регулирует собственный набор эффекторов и контролируется отдельными группами GEF, GAP и GDI. Эффекторы, находящиеся под контролем этих групп белков, включают фосфолипазы С и D, различные протеинкиназы и липидные киназы, белки, участвующие в нуклеации или реорганизации актиновых филаментов, и компоненты системы генерации активного кислорода в нейтрофилах.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Регуляторная функция белков: описание, характеристики и особенности
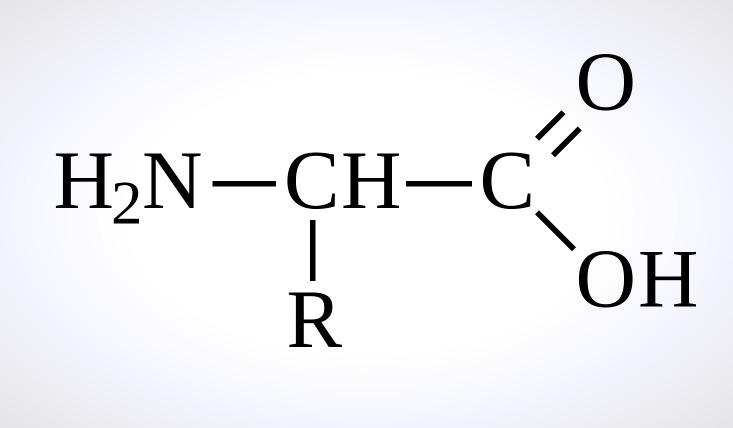
Белки – это высокомолекулярные органические вещества, которые состоят из альфа-аминокислот, что соединены пептидной связью в единую цепочку. Их главная функция – регуляторная. И о том, в чем и как она проявляется, сейчас следует рассказать в подробностях.
Описание процесса
Белки обладают способностью принимать и передавать информацию. С этим и связано осуществление ими регуляции происходящих в клетках и во всем организме в целом процессов.

Интересно, что регулярно ученые открывают новые регуляторные белки. Предполагается, что на сегодняшний день известна лишь малая их часть.
Белки, выполняющие регуляторную функцию, делятся на разновидности. И о каждой из них стоит рассказать в отдельности.
Функциональная классификация

Она довольно-таки условная. Ведь один гормон может выполнять самые разные задачи. Но вообще регуляторная функция обеспечивает продвижение клетки по ее циклу, дальнейшую транскрипцию, трансляцию, сплайсинг и активность иных белковых соединений.
Происходит все благодаря связыванию с другими молекулами либо вследствие ферментативного воздействия. К слову, эти вещества играют очень важную роль. Ведь ферменты, являясь сложными молекулами, ускоряют химические реакции в живом организме. И некоторые из них подавляют активность других белков.
А вот теперь можно перейти к изучению видовой классификации.
Белки-гормоны
Они оказывают влияние на различные физиологические процессы и непосредственно на обмен веществ. Белки-гормоны формируются в железах внутренней секреции, после чего переносятся кровью с целью передать информационный сигнал.
Они распространяются хаотично. Однако действуют исключительно на те клетки, у которых есть специфические белки-рецепторы. Только с ними гормоны могут связаться.
Как правило, гормонами регулируются медленные процессы. К таковым можно отнести развитие организма и рост отдельных тканей. Но и тут есть исключения.

Таковым является адреналин – производное аминокислот, основной гормон мозгового вещества надпочечников. Его выделение провоцирует воздействие нервного импульса. Учащается сердцебиение, повышается кровяное давление, возникают другие ответные реакции. Влияет он и на печень – провоцирует расщепление гликогена. В результате в кровь выделяется глюкоза, и мозг с мышцами используют ее в качестве источника энергии.
Белки-рецепторы
Они также обладают регуляторной функцией. Организм человека – это, по сути, сложная система, постоянно получающая сигналы из внешней и внутренней среды. Этот принцип наблюдается и в работе составляющих его клеток.
Так, например, мембранные рецепторные белки передают сигнал с поверхности структурно-элементарной единицы внутрь, параллельно преобразовывая его. Они регулируют клеточные функции благодаря связыванию с лигандом, находящимся на рецепторе снаружи клетки. Что происходит в итоге? Другой белок внутри клетки активируется.
Стоит отметить один важный нюанс. Подавляющее большинство гормонов влияют на клетку лишь в том случае, если на ее мембране имеется определенный рецептор. Им может быть гликопротеид или другой белок.
Можно привести пример – β2-адренорецептор. Он находится на мембране печеночных клеток. Если происходит стресс, то с ним связывается молекула адреналина, вследствие чего β2-адренорецептор активируется. Что происходит далее? Уже активированный рецептор задействует G-белок, который в дальнейшем присоединяет ГТФ. Спустя множество промежуточных этапов, происходит фосфоролиз гликогена.
Какой вывод? Рецептор осуществил первое действие по передаче сигнала, который привел к расщеплению гликогена. Выходит, без него последующие реакции, происходящие внутри клетки, не произошли бы.
Белки-регуляторы транскрипции
Еще одна тема, которую необходимо затронуть вниманием. В биологии существует понятие транскрипционного фактора. Так называются белки, которым также присуща регуляторная функция. Она заключается в контроле процесса синтеза мРНК на ДНК-матрице. Это называется транскрипцией – переносом генетической информации.
Что можно сказать о данном факторе? Белок выполняет регуляторную функцию либо самостоятельно, либо совместно с другими элементами. Результатом становится снижение или повышение константы связывания РНК-полимеразы с последовательностями регулируемого гена.
У факторов транскрипции есть определяющая черта – наличие в составе одного или нескольких ДНК-доменов, взаимодействующих с конкретными ДНК-участками. Это важно знать. Ведь у других белков, также участвующих в регуляции экспрессии генов, отсутствуют ДНК-домены. Это значит, что их к транскрипционным факторам отнести нельзя.
Протекинкиназы
Рассказывая о том, какие элементы выполняют в клетках регуляторную функцию, необходимо отметить вниманием и эти вещества. Протекинкиназы являются ферментами, модифицирующими другие белки посредством фосфорилирования остатков аминокислот с гидроксильными группами в составе (это тирозин, треонин и серин).
Что представляет собой данный процесс? В ходе фосфорилирования обычно изменяется либо модифицируется функция субстрата. Активность фермента, к слову, также может изменяться, как и положение белка в самой клетке. Интересный факт! Предполагается, что порядка 30% белков могут модифицироваться с помощью протеинкиназ.
А их химическая активность прослеживается в отщеплении от АТФ фосфатной группы и в дальнейшем ковалентном присоединении к остатку какой-либо аминокислоты. Таким образом, протеинкиназы оказывают сильное влияние на клеточную жизнедеятельность. Если нарушится их работа, то могут развиться различные патологии, даже некоторые виды рака.
Протеинфосфатазы
Продолжая изучать особенности и примеры регуляторной функции, следует обратить внимание и на эти белки. Действие, осуществляемое протеинфосфатазами, заключается в отщеплении фосфатных групп.
Что это значит? Выражаясь простым языком, данные элементы выполняют дефосфорилирование – процесс, обратный тому, который происходит в результате воздействия протеинкиназ.
Регуляция сплайсинга
Ее также нельзя обойти вниманием. Сплайсинг – это процесс, в ходе которого из молекул РНК удаляются некоторые нуклеотидные последовательности, а затем соединяются последовательности, которые сохранились в «зрелой» молекуле.
Какое отношение он имеет к изучаемой теме? Внутри генов эукариот имеются участки, которые не кодируют аминокислоты. Называют их интронами. Сначала они переписываются при транскрипции на пре-мРНК, после чего особый фермент их «вырезает».
В сплайсинге участвуют только те белки, которые являются ферментативно активными. Только они способны придать нужную конформацию прем-РНК.
Кстати, еще существует понятие альтернативного сплайсинга. Это очень интересный процесс. Белки, участвующие в нем, препятствуют вырезанию одних нитронов, но при этом способствуют удалению других.
Углеводный обмен
Регуляторную функцию в организме выполняют многие органы, системы и ткани. Но, раз речь идет о белках, то и о роли углеводов, также являющихся важными органическими соединениями, тоже стоит рассказать.
Это очень подробная тема. Углеводный обмен в целом собой представляет огромное количество ферментативных реакций. И одна из возможностей его регуляции – преобразование активности ферментов. Достигается оно вследствие функционирующих молекул определенного фермента. Либо в результате биосинтеза новых.
Можно сказать, что регуляторная функция углеводов основывается на принципе обратной связи. Сначала избыток субстрата, который поступает в клетку, провоцирует синтез новых ферментных молекул, а затем происходит торможение их биосинтеза (ведь именно к этому приводит накопление метаболических продуктов).
Регуляция обмена жиров
Об этом напоследок. Раз уж было сказано о белках и углеводах, то и жиры нужно упомянуть.
Процесс их обмена тесно связан с углеводным. Если в крови повышается концентрация глюкозы, то распад триглицеридов (жиров) уменьшается, вследствие чего активизируется их синтез. Уменьшение ее количества, наоборот, оказывает тормозящее влияние. В результате расщепление жиров усиливается и ускоряется.
Из всего этого следует простой и логичный вывод. Взаимосвязь углеводного и жирового обмена направлена лишь на одно – на обеспечение испытываемых организмом энергетических потребностей.
Основные функции белков в клетке
Благодаря сложности, разнообразию форм и состава, белки играют важную роль в жизнедеятельности клетки и организма в целом.
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипептид — понятие химическое. Белок — понятие биологическое.
В биологии функции белков можно разделить на следующие виды:
1. Строительная функция
Белки участвуют в образовании клеточных и внеклеточных структур. Например:
2. Транспортная функция
Некоторые белки способны присоединять различные вещества и переносить их к различным тканям и органам тела, из одного места клетки в другое. Например:
Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
3. Регуляторная функция
Большая группа белков организма принимает участие в регуляции процессов обмена веществ. Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например:
4. Защитная функция
5. Двигательная функция
6. Сигнальная функция
7. Запасающая функция
8. Энергетическая функция
9. Каталитическая (ферментативная) функция
Ферменты, или энзимы, — особый класс белков, являющихся биологическими катализаторами. Благодаря ферментам биохимические реакции протекают с огромной скоростью. Вещество, на которое оказывает свое действие фермент, называют субстратом.
Ферменты можно разделить на две группы:
10. Функция антифириза
11. Питательная (резервная) функция.
Решай задания и варианты по биологии с ответами
Биология. 11 класс
§ 4-1. Функции белков
Белки выполняют разнообразные биологические функции — структурную, транспортную, регуляторную и многие другие. При этом одной из самых важных функций белков в живых организмах является каталитическая (ферментативная).
Ферменты. Из курса химии вы знаете, что вещества, повышающие скорость химических реакций, называются катализаторами. Ферменты *(энзимы)* — это белки, которые выполняют функции биологических катализаторов, т. е. ускоряют протекание химических реакций в живых организмах. Без их участия биохимические процессы происходили бы слишком медленно или не происходили бы вообще. Ферменты осуществляют расщепление и синтез различных соединений, обеспечивая протекание обмена веществ. Практически все процессы жизнедеятельности обусловлены ферментативными реакциями.

Присоединение субстрата вызывает небольшие изменения конфигурации активного центра — такие, чтобы максимально соответствовать субстрату. Функционально активные группы фермента, за счет которых будет протекать реакция, наиболее благоприятным образом располагаются в пространстве. Образно говоря, активный центр подстраивается под субстрат как перчатка, которую надевают на руку.
В результате присоединения к активному центру молекула субстрата особым образом располагается в пространстве, и в ее структуре ослабляются определенные химические связи. Реакционная способность субстрата возрастает. Поэтому, по сравнению с некатализируемой реакцией, ферментативное превращение субстрата в продукт (или продукты) происходит с меньшими затратами энергии и гораздо большей скоростью. Образовавшиеся продукты отделяются от активного центра. После этого он может принимать новые молекулы субстрата.
Сходство ферментов с обычными химическими катализаторами проявляется в том, что и те и другие увеличивают скорость реакции, но при этом не расходуются и могут использоваться многократно.
В ходе некоторых окислительно-восстановительных процессов, протекающих в живых организмах, образуется токсичное для клеток соединение — пероксид водорода (Н2О2). Без участия катализаторов его расщепление идет очень медленно: 2H2O2 → 2H2O + O2. Вы знаете, что в лаборатории при проведении этой реакции обычно используют неорганический катализатор, например оксид марганца (MnO2). В его присутствии разложение Н2О2 происходит значительно быстрее. В живых организмах под действием фермента каталазы этот процесс протекает с удивительно высокой скоростью: одна молекула каталазы расщепляет за 1 с около 200 000 молекул H2O2!
Ферменты являются белками, поэтому активно работают лишь в определенном диапазоне рН, температуры и других факторов. Например, фермент желудочного сока пепсин активен только в кислой среде, а ферменты слюны амилаза и мальтаза — в слабощелочной. В диапазоне 0—40 °С повышение температуры приводит к ускорению ферментативных реакций. Но при дальнейшем увеличении температуры реакции, катализируемые большинством ферментов, замедляются, а затем вовсе прекращаются. Значительное повышение температуры, изменение кислотности среды и других факторов приводит к денатурации ферментов, в результате чего они теряют способность связываться со своими субстратами.
*Существуют ферменты, которые, кроме активного центра, имеют один или несколько регуляторных (аллостерических) центров. С активным или регуляторным центром, либо с другими участками молекулы фермента могут связываться определенные вещества, влияющие на его активность. Вещества, повышающие скорость ферментативной реакции, называются активаторами, снижающие или блокирующие активность фермента — ингибиторами.
Ингибиторы, которые связываются с регуляторным (аллостерическим) центром, вызывают изменения пространственной конфигурации (конформации) фермента, приводящие к уменьшению его активности. Такой тип ингибирования называется аллостерическим (рис. 4-1.2, а).
Некоторые соединения, по структуре сходные с субстратом, могут связываться с активным центром фермента, но не способны подвергаться ферментативному превращению. Такие вещества препятствуют доступу субстрата в активный центр, тем самым снижая скорость ферментативной реакции. Поскольку молекулы субстрата и ингибитора конкурируют за активный центр, данный тип ингибирования назван конкурентным (рис. 4-1.2, б).
Известно также неконкурентное ингибирование, при котором ингибиторы присоединяются к молекуле фермента вне активного и регуляторного центров. Неконкурентные ингибиторы не мешают связыванию ферментов с субстратами, но вызывают такие изменения структуры, которые не позволяют ферменту превращать субстрат в продукт (рис. 4-1.2, в). Примером могут служить цианид-ионы (CN – ). Они подавляют активность ряда ферментов за счет связывания с ионами металлов, выполняющими роль кофакторов.*
*Ферменты широко используются в пищевой промышленности (при производстве сыров и других кисломолочных продуктов, соков, чая, овощных и фруктовых пюре, в хлебопечении, пивоварении, виноделии, для обработки мяса и т. п.). Их также применяют в сельском хозяйстве для получения кормов, в медицине для диагностики и лечения заболеваний, в текстильной и кожевенной промышленности для обработки тканей, кожи и меха, в производстве синтетических моющих средств и др.*
Кроме каталитической, белки выполняют и другие важные функции (таблица 4-1.1 ).
Функция
Пояснение и примеры
Являются биологическими катализаторами — повышают скорость протекания биохимических реакций, обеспечивая расщепление, синтез и внутримолекулярную перестройку различных соединений. Например, пищеварительные ферменты липазы ускоряют расщепление липидов, амилаза и мальтаза — углеводов, пепсин и трипсин — белков. *Рибулозодифосфат-карбоксилаза обеспечивает связывание углекислого газа в процессе фотосинтеза. Удвоение молекул ДНК происходит под действием фермента ДНК-полимеразы, образование РНК — под действием РНК-полимеразы*
Входят в состав всех компонентов клеток и различных внеклеточных структур. Например, кератин — основной компонент волос, ногтей, когтей, копыт, рогов, перьев. Эластин входит в состав стенок артерий, связок и др., коллаген — в состав кожи, сухожилий, костной, хрящевой и других тканей. *Склеротин является компонентом наружного скелета насекомых и паукообразных. Фиброин составляет основу коконов насекомых*
Переносят различные вещества от одних клеток и тканей к другим, обеспечивают их поступление в клетки, выведение из клеток, а также процессы внутриклеточного транспорта. Например, дыхательный пигмент гемоглобин переносит кислород и углекислый газ в крови позвоночных животных, а у многих моллюсков и ряда членистоногих эту функцию выполняет гемоцианин. *Глобулины плазмы крови транспортируют гормоны и ионы металлов (например, трансферрин — ионы железа, церулоплазмин — ионы меди), альбумины переносят высшие карбоновые кислоты и некоторые другие вещества*
Принимают участие во всех видах движения, к которым способны клетки и организмы. Например, белки актин и миозин обеспечивают сократимость гладкой и поперечнополосатой мышечных тканей. *В основе движения жгутиков и ресничек эукариотических клеток лежит скольжение друг относительно друга микротрубочек, входящих в их состав. Оно обеспечивается взаимодействием белков тубулина и динеина*
Регулируют протекание различных физиологических процессов. Например, гормоны инсулин и глюкагон регулируют уровень глюкозы в крови. Процессы роста и физического развития человека протекают под контролем гормона соматотропина. *Другие тропные гормоны, секретируемые передней и средней долями гипофиза, также представляют собой полипептиды. Например, тиреотропин, стимулирующий деятельность щитовидной железы, гонадотропины, регулирующие работу половых желез, пролактин, контролирующий развитие и функционирование молочных желез и т. п. Гормон щитовидной железы кальцитонин и паратгормон, вырабатываемый паращитовидными железами, регулируют содержание ионов Са 2+ в организме*
Некоторые мембранные белки в ответ на действие определенных химических веществ или раздражителей иной природы изменяют свою конфигурацию. Это приводит к изменению протекания тех или иных внутриклеточных процессов. Таким образом, рецепторные белки обеспечивают прием внешних сигналов и ответные реакции клеток на эти сигналы. Например, зрительные пигменты глаза — родопсин (содержится в палочках) и йодопсины (в колбочках) — обеспечивают восприятие света фоторецепторными клетками, их возбуждение и запуск нервного импульса. *Другими примерами могут служить мембранные рецепторы, которые связывают молекулы гормонов, нейромедиаторов и др. Светочувствительный белок фитохром обеспечивает реакцию растений на изменение длины светового дня (фотопериодизм). Он играет важную роль в регуляции цветения, прорастания семян, формирования листьев и т. д.*
Токсины, выделяемые многими бактериями (дифтерийный, ботулиновый, столбнячный, холерный и др.) по химической природе являются белками. Действующие вещества в составе ядов змей, некоторых пауков, скорпионов и насекомых также представляют собой белки
Запасаются в качестве источника аминокислот, например, резервные белки, которые откладываются в семенах растений *(легумин, запасающийся в семенах бобовых и др.)*, или обеспечивают запасание других веществ. Так, миоглобин играет важную роль в создании кислородного запаса в мышечных волокнах. *Ферритин выполняет роль основного внутриклеточного депо железа у человека и животных*
После гидролиза до аминокислот могут подвергаться дальнейшему расщеплению и окислению с высвобождением энергии. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки используются в качестве источника энергии лишь в крайних случаях, когда истощаются запасы углеводов и жиров
*Натуральный шелк, получаемый из коконов шелкопряда, на 75 % состоит из фиброина и на 25 % из серицина. Фиброин — нерастворимый белок, вторичная структура которого (β-складчатый слой) обусловливает прочность шелка. Волокна шелка образованы фиброиновыми нитями. Снаружи они покрыты клейким водорастворимым серицином, который при производстве тканей удаляется. Шелковая нить имеет треугольное сечение и, как призма, преломляет свет, что вызывает красивое переливание и блеск. Шелк использовался для изготовления тканей еще в 4-ом тысячелетии до н. э. Шелковое волокно применяют в качестве шовного материала в хирургии.*
У пауков основу паутины составляет белок спидроин. Секрет паутинных желез выводится наружу в жидком виде. После этого структура спидроина изменяется, и он затвердевает в виде тонких нитей. В их составе участки β-складчатого слоя чередуются с эластичными полипептидными связками. Благодаря этому паутина обладает одновременно высокой прочностью и эластичностью. Она разрывается лишь при растяжении в 5 раз. По прочности паутина сопоставима со сталью, но при этом ее плотность в 6 раз меньше, чем у стали. Если бы паук создал нить длиной в земной экватор, она имела бы массу менее 500 г.