Что выделяют тучные клетки
Что выделяют тучные клетки
Тучные клетки образуются из CD34 кроветворных клеток-предшественниц, которые из костного мозга попадают в кровь, а затем и в ткани, где подвергаются тканеспецифическому созреванию. Для развития и выживания тучных клеток необходимо взаимодействие их рецепторной тирозинкиназы c-kit с выделяемым фибробластами лигандом c-kit, ФСК. В отличие от зрелых базофилов, зрелые тучные клетки в крови обычно отсутствуют. Они концентрируются в соединительной ткани, где часто располагаются рядом с кровеносными сосудами под эпителиальными поверхностями, контактирующими с внешней средой (дыхательные пути, ЖКТ и кожа).
Таким образом, уже само расположение тучных клеток способствует их участию в аллергических реакциях. У человека различают по крайней мере две субпопуляции тучных клеток: одни из них содержат только триптазу, другие — и триптазу и химазу. Первые локализуются преимущественно в легких и слизистой оболочке тонкой кишки, тогда как вторые обнаруживаются в коже, подслизистом слое ЖКТ и кровеносных сосудах.
В ответ на стимуляцию тучные клетки выделяют многочисленные медиаторы, которые по-разному влияют на аллергическое воспаление и функцию органов. К этим веществам относятся уже имеющиеся в гранулах медиаторы (например, гистамин, сериновые протеазы и протеогликаны), а также синтезируемые de novo мембранные липиды, цитокины и хемокины. Наиболее важные медиаторы липидной природы — это продукты циклооксигеназного и липоксигеназного путей метаболизма арахидоновой кислоты, обладающие высокой провоспалительной активностью.
Главным продуктом циклооксигеназного пути является простагландин D2, а основными продуктами липоксигеназного пути — сульфидопептиды лейкотриены (лейкотриен С4 и его производные D4 и Е4). Тучные клетки продуцируют и цитокины, в том числе и те, которые стимулируют ответ Th2-клеток (ИЛ-4, ИЛ-13, ГМ-КСФ), способствуют воспалительной реакции (ФНО-а, ИЛ-6) и регулируют перестройку ткани (трансформирующий фактор роста, фактор роста эндотелия). Иммунная активация тучных клеток и базофилов обычно начинается с перекрестного связывания комплекса FceRI и IgE с поливалентным аллергеном.
Что выделяют тучные клетки
Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем.
Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина.
У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани.
Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции.
Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля.
Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений.
ТУЧНЫЕ КЛЕТКИ
Тучные клетки (син.: гепариноциты, лаброциты, мастоциты, тканевые базофилы) — одна из основных клеточных форм соединительной ткани; характеризуются наличием в цитоплазме обильной метахроматической зернистости и способностью вырабатывать, хранить и выделять биологически активные вещества (гепарин, гистамин и др.).
Тучные клетки и их гранулы впервые описаны в 1877 г. П. Эрлихом; в 1902 — 1906 гг. А. А. Максимов подробно исследовал Тучные клетки у различных животных. В наст. время Тучные клетки выявлены у многих позвоночных животных, в т. ч. у всех млекопитающих. Тучные клетки описаны в большинстве органов, однако наиболее часто они локализуются в рыхлой волокнистой соединительной ткани около мелких сосудов, под эпителием и вблизи желез кожи, слизистых и серозных оболочек, в капсуле и трабекулах паренхиматозных органов, в лимфоидных органах, перитонеальной жидкости.
Количество, распределение и структура Тучных клеток имеют видовые, индивидуальные и возрастные особенности. Размеры Т. к. у человека варьируют от 3,5 до 14 мкм, они бывают веретенообразной или округлой формы (рис. 1). Цитоплазматическая мембрана (плазмолемма) образует складки и микроворсинки. Ядро обычно округлое или овальное. В цитоплазме (см.) расположены мембранные и немембранные органеллы. К мембранным органе л лам относятся эндоплазматическая сеть (см. Эндоплазматический ретикулум), комплекс Гольджи (см. Гольджи комплекс), митохондрии и лизосомы; к немембранным — рибосомы, центриоли, макротрубочки и микрофиламенты. Большая часть цитоплазмы занята гранулами, количество, размеры, структура, хим. состав и тинкториальные свойства к-рых имеют видовые особенности и зависят от степени их зрелости и функционального состояния клетки. Диаметр гранул варьирует от 0,3 до 2 мкм. Основу их составляет комплекс гепарина (см.) и основных белков, к к-рому присоединен гистамин (см.), а у ряда животных серотонин (см.) и дофамин (см. Катехоламины). В Т. к. при участии ферментов арилсульфатазы, сульфат-аденилил-трансферазы синтезируется гепарин — сульфатированный гликозаминогликан. Слабо сульфатированный гепарин локализуется в молодых клетках и обусловливает ортохроматическую окраску гранул; сильно сульфатированный гепарин находят в зрелых клетках, он обусловливает их мета хроматическую окраску (см. Метахромазия). В гранулах могут содержаться и другие гликозаминогликаны — хондроитинсульфаты (см. Хондроитинсерные кислоты), гиалуроновые кислоты (см.), а также гликопротеиды (см.). Кроме основных белков, в Т. к. представлены протеолитические ферменты (химаза и триптаза), а также оксид азы (см.), декарбоксилазы (см.), фосфатазы (см.) и другие. Т. к. могут синтезировать гистамин при участии фермента гистидиндекарбоксилазы, а также поглощают его извне. Гранулы могут иметь фибриллярную, пластинчатую, сетчато-зернистую и кристаллоидную структуру. В формировании гранул Т. к., в частности синтезе белков, участвует эндоплазматическая сеть, а также комплекс Гольджи (см. Гольджи комплекс), где образуются гликозаминогликаны и их комплексы с белками. Вначале в области комплекса Гольджи появляются небольшие (около 70 нм), окруженные мембраной плотные програнулы, к-рые объединяются в вакуоли с общей мембраной. Затем расположенные внутри мембраны програнулы сливаются, образуя рыхлую структуру. В процессе созревания гранулы происходит уплотнение ее содержимого, что определяет полиморфизм структуры гранул в зависимости от степени их зрелости. Зрелые гранулы отличаются от незрелых большей электронной плотностью и гомогенностью (рис. 2).
Одним из способов секреции (выделения) биологически активных веществ Т. к. является дегрануляция (рис. 3), к-рая происходит путем экзоцитоза, являющегося переходной формой к апокриновому типу секреции (см. Железы). Секреция может быть также мерокриновой, т. е. вещества могут выделяться без дегрануляции, и реже голокриновой, сопровождающейся разрушением Т. к. Усиленная дегрануляция является показателем повышенной функциональной активности Т. к. и наблюдается при действии многих физических, химических и биологических факторов. Обычно дегрануляция сопровождается процессом восстановления гранул.
Происхождение Тучных клеток окончательно не установлено. Предполагают, что они развиваются из лимфоцитоподобного костномозгового предшественника. Популяция Т. к. обновляется медленно. Т. к. имеют низкую пролиферативную активность. В полностью гранулированных Т. к. митозы (см. Митоз) встречаются редко, чаще — в менее гранулированных клетках. Способность Т. к. к пролиферации связана с их секреторной активностью. Существует обратная зависимость между количеством Т. к. и базофилов в крови: так, у крыс, мышей при высоком содержании Т. к. базофилы в крови отсутствуют, у морских свинок, кроликов, птиц при малом содержании Т. к. в крови отмечается большое количество базофилов. Т. к. отличаются от базофилов крови происхождением, строением и функцией. Количество, структура и функциональная активность Т. к. зависят от возраста и нейрогормонального статуса организма. Отмечено влияние на Т. к. гормонов гипофиза (соматотропного, тиреотропного и адренокортикотропного), щитовидной железы (тироксина), поджелудочной железы (инсулина), половых гормонов (эстрогенов, прогестерона, тестостерона).
Функции Т. к. многообразны. Они участвуют в развитии воспаления, регуляции свертывания крови, жировом обмене, обеспечивают постоянство состава соединительной ткани, влияя на микроциркуляторное русло (см. Микроциркуляция), образование и проницаемость основного вещества, на размножение, миграцию и функцию фибробластов (см. Соединительная ткань), макрофагов (см.), эндотелиоцитов (см. Эндотелий), лейкоцитов (см.), а также на иммунные реакции.
Роль тучных клеток в аллергии
Тучные клетки, так же как и базофилы, являются основными клетками-мишенями аллергической реакции. Они вовлекаются в аллергическую реакцию посредством соединения фиксированных на клеточной мембране аллергических антител (реагинов), преимущественно принадлежащих к IgE (см. Иммуноглобулины), с аллергеном. Это приводит, по мнению И. С. Гущина, Б. Увнеса, Джонсона (A. R. Johnson) и Морана (N. С. Moran), к активации Т. к. и высвобождению из них разнообразных биологически активных веществ, к-рые, действуя на другие клетки и ткани, вызывают внешние проявления реакции гиперчувствительности немедленного типа, или химергической аллергической реакции (см. Медиаторы аллергических реакций). Таким образом, реакция Т. к. является обязательным и важнейшим звеном аллергических реакций, лежащих в основе анафилаксии (см.), неинфекционно-аллергической бронхиальной астмы (см.), аллергических ринитов (см. Ринит), конъюнктивитов (см.), отека Квинке (см. Квинке отек), крапивницы (см.) и других проявлений атопии (см.).
Имеются сведения, что Т. к. могут принимать участие и в реакциях гиперчувствительности замедленного типа, благодаря способности антигенспецифических Т-лимфоцитов при взаимодействии с антигеном выделять лимфокины (см. Медиаторы клеточного иммунитета), вызывающие в свою очередь активацию Т. к. и высвобождение из них медиаторов и других биологически активных веществ.
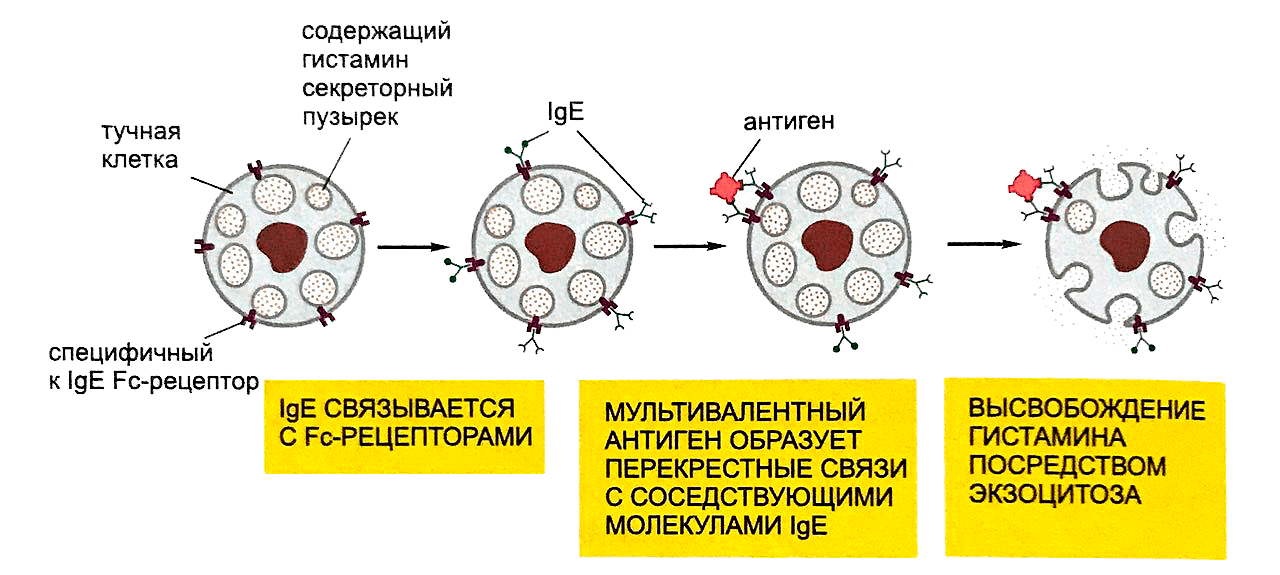
Избирательная фиксация IgE-антител на Тучных клетках объясняется присутствием в их цитоплазматической мембране специфических для IgE рецепторов (ок. 300 000 рецепторов на одну Т. к.). За связывание IgE с рецепторами ответственны участки в области С84-домена молекулы IgE. Рецептором для IgE является гликопротеид с мол. весом (массой) порядка 50 000. Для активации Т. к. необходимо соединение между собой соседних, расположенных на мембране Т. к., молекул IgE-антител молекулой антигена, к-рая должна иметь для этого не менее двух валентностей. Моновалентные антигены не активируют Т. к., но тормозят активацию, вызванную мульти-валентными антигенами. Связывание антигенными мостиками IgE-антител приводит к сближению последних на клеточной мембране и, соответственно, к сближению мембранных рецепторов IgE-антител, что является толчком к активации Т. к. Не исключено, что активация Т. к. осуществляется путем взаимодействия участков С83-домена, открывающихся в структурно измененной молекуле IgE-антитела, с участками клеточной мембраны, отличными от рецепторов для IgE.
По данным, полученным с помощью фазово-контрастной микроскопии, реакция сенсибилизированных Т. к. на антиген морфологически проявляется в увеличении их размера, «вскипании» клетки, к-рое сопровождается утратой цитоплазматических гранул в результате дегрануляции или гранулолизиса, потерей четкости очертаний клетки, что может быть принято за ее разрушение. Об отсутствии разрушения Т. к. при аллергической реакции свидетельствует то, что при дегрануляции из них не высвобождаются АТФ, лактат-дегидрогеназа и предварительно введенные в клетки радиоактивные калий (42K) или хром (51Cr), как это происходит при заведомо цитотоксических воздействиях.
За счет образования видимых сообщений и зон повышенной проницаемости цитоплазматической мембраны содержащиеся во внеклеточной среде ионы Na + усиленно поступают в вакуоли и вытесняют биогенные амины (см. Медиаторы аллергических реакций), соединенные ионной связью с белками гранулярного матрикса.
Наряду с высвобождением из Т. к. гистамина, серотонина, эозинофильного хемотаксического фактора — ECF-A (англ. eosinophilic chemotactic factor of anaphylaxis), нейтрофильного хемотаксического фактора — NCF (англ. neutrophil chemotactic factor), содержащихся в гранулах Т. к. в предсуществующей (предобразованной) форме, происходит активация ферментов и образуются такие медиаторы, как медленно реагирующая субстанция анафилаксии SRS-A (англ. slow-reacting substance of anaphylaxis), фактор, активирующий тромбоциты — PAP (англ. platelet activating’ factor), и липидные хемотаксичоские факторы.
Из фосфолипидов клеточной мембраны активированных Тучных клеток высвобождается арахидоновая кислота (см.). В результате окислительного превращения арахидоновой к-ты, катализируемого циклооксигеназой (циклооксигеназный путь), образуются простагландины и тромбоксаны (см. Простагландины). Окислительное превращение арахидоновой к-ты, катализируемое липокспгеназой (липоксигеназныи путь), приводит к образованию гидроксиэйкозатетраеновых к-т, обладающих гуморальной и клеточной активностью: они оказывают хемотаксическое действие на эозииофилы, усиливают сродство клеточных мембранных рецепторов к СЗЬ компоненту комплемента (см.), стимулируют активность аденилат- и гуанилатциклаз. Кроме того, в результате окислительного превращения арахидоновой к-ты по липоксигеназному пути образуются лейкотриены. Полагают, что лейкотриены С4 (ЛТС4), Дд (ЛТДл) и Е4 (JITEj) представляют собой SRS-A, поэтому ингибиторы лииоксигеиазы тормозят высвобождение SRS-A из тучных клеток и оказывают тем самым противоаллергическое действие.
Дегрануляция Т. к. и высвобождение из них медиаторов находятся под частичными контролем системы циклических нуклеотидов: циклического 3′,5′-АМФ (цАМФ) и циклического 3′,5′-гуанозинмоно-фосфата (цГМФ). Увеличение внутриклеточного содержания цАМФ ослабляет, а увеличение содержания цГМФ усиливает секрецию медиаторов. Однако в регуляции аллергической реакции Т. к. система аденилатциклаза — цАМФ имеет относительное значение. Аденилатциклаза Т. к. может быть стимулирована простагландинами Е (ПГЕ), гистамином и в значительно меньшей степени, чем в других клетках, стимуляторами Р-адренергических рецепторов. Противоаллергическое действие ингибиторов фосфодиэстеразы можно частично объяснить торможением выброса медиаторов из Т. к. за счет повышения содержания в клетках цАМФ.
Доказательство нецитотоксической природы дегрануляции Т. к. обосновало новый принцип подхода к контролю за аллергическими реакциями, состоящий в стабилизации этих клеток и торможении их функции. Противоаллергический препарат интал обладает стабилизирующим действием на Т. к. и тормозит высвобождение из них медиаторов в ответ на аллерген.
Библиогр.: Адо А. Д. Общая аллергология, М., 1978;
Гущин И. С. Немедленная аллергия клетки, М., 1976; Елисеев В. Г. Соединительная ткань, с. 115, М., 1961; Серов В. В. и Шехтер А. Б. Соединительная ткань, с. 62, М., 1981; Хрущов Н. Г. Функциональная цитохимия рыхлой соединительной ткани, М., 1969; Юрина Н. А. и Радостина А. И. Тучные клетки и их роль в организме, М., 1977; Asboe-Hansen О. The mast cell, Int. Rev. Cytol., v. 3, p. 399, 1954; Boot J. R. a. o. The anti-allergic activity of Benoxaprofen [2-(4-Chloropheny])-a-Methyl-5-Benzoxazole acetic acidj-a lipoxygenase inhibitor, Int. Arch. Allergy, v. 67, p. 340, 1982; Fernex M. The mast-cell system, its relationship to atherosclerosis, fibrosis and eosinophils, Baltimore, 1968; Goetzl E. J. Mediators of immediate hypersensitivity derived from arachidonic acid, New Engl. J. Med., v. 303, p. 822, 1980; Ishizaka T. Membrane events in triggering mast cells for IgE-mediated histamine release, в кн.: Advanc. allerg. clin. immunol., ed. by A. Oehling a. о., p. 157, Oxford a. o., 1979; Laglinoff D. a. Chi E. Y. Cell biology of mast cells and basophils, в кн.: Cell biology of inflammation, ed. by G. Weiss manii, p. 217, Amsterdam — N. Y., 1980; Maximоw A. A. Bindegewebe und blutbildende Gewebe, Handb. d. mikr. Anat. d. Menschen, hrsg. v. W. Mollendorff, Bd 2, T. 1, S. 232, B., 1927; Rileу J. F. The mast cells, Edinburgh — L., 1959; Schauer A. Die Mastzelle, Stuttgart, 1964; Sedwick J. D., Holt P. G. a. Turner K. J. Production of a histamine-releasing lymphokine by antigen-or mitogen-stirnulated human peripheral T cells, Clin. exp. Immunol., v. 45, p. 409, 1981; Selye H. The mast cells, Washington, 1965; Velican C. a- Velican D. Histogenesis of mast cells, Folia histochem. cytochem., v. 1, p. 433, 1963; WassermanS. I. The lung mast cell, its physiology and potential relevance to defense of the lung, Environ. Hltii Perspect., v. 35, p. 153, 1980.
H. А. Юрина; И. С. Гущин (алл.).
LTP: маленькие виновники больших неприятностей
Грустный ребенок, которому нельзя есть апельсин
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Аллергию называют болезнью XXI века. Иммунитет призван защищать организм, но в этом случае он дает сбой. В чем причина? Статья знакомит с одним из сильнейших пищевых аллергенов — растительными липид-транспортирующими белками, их структурой и функциями.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Введение
Как вы отреагируете на сообщение, что в мире возникла новая «эпидемия»? По данным ВОЗ, от нее страдает 20% населения Европы. Это заболевание занимает третье место по распространенности в мире. Наверное, вы уже догадались, что речь идет об аллергии. Если открыть учебник по биологии и посмотреть определение данного недуга, то сразу станет ясно, что причина аллергии скрывается в некоем сбое иммунной системы. Иммунная система является главным защитником нашего организма от вирусов, бактерий, простейших, гельминтов — одним словом, от патогенов. Основными игроками иммунитета являются специальные клетки организма — лейкоциты.
Лейкоциты подразделяются на несколько групп [1]:
Собственно в первом приближении борьба иммунной системы с патогеном выглядит так: при попадании патогена в организм происходит активация первой линии защиты — нейтрофилов и макрофагов. Макрофаги, а также дендритные клетки способны активировать лимфоциты, которые начинают направленно убивать патогенов-чужаков. Более подробно с лимфоцитами и иммунным ответом можно ознакомиться в статье «Иммунитет: борьба с чужими и. своими» [1].
Строение и классификация антител
Антитела — это Y-образные молекулы из суперсемейства белков иммуноглобулинов, содержащие два участка связывания с антигеном [3].
Антиген — это молекула на поверхности патогена, способная к связыванию с антителом.
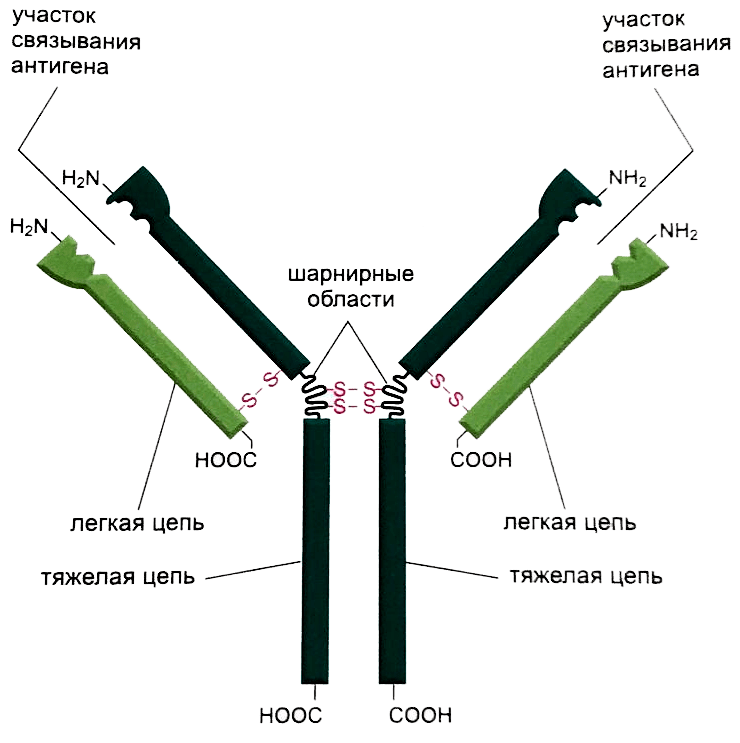
Антитело состоит из четырех полипептидных цепей: двух идентичных легких цепей и двух идентичных тяжелых (рис. 1). Между собой цепи соединены с помощью электростатических, ван-дер-ваальсовых и ковалентных дисульфидных связей [3]. Не связанная с легкими цепями часть тяжелых цепей образует шарнирные области и хвост (Fc-фрагмент) антитела.
Рисунок 1. Строение антитела
Шарнирная область — это достаточно гибкое место молекулы, за счет которого расстояние между двумя связывающими антиген участками может изменяться, что значительно повышает эффективность взаимодействия с антигеном [3].
У млекопитающих выделяют пять классов антител: IgA, IgD, IgE, IgG, IgM. Каждый класс имеет свой тип тяжелой цепи, а значит свой уникальный Fc-фрагмент, что придает молекулам одного класса характерные свойства. Строение хвостовой части антитела влияет на такие свойства, как связывание с фагоцитирующими клетками, пересечение плацентарного барьера и другие. Специальные Fc-рецепторы, расположенные на мембране лейкоцитов распознают Fc-фрагмент антитела определенного класса и затем связываются с ним. Другими словами, для каждого типа антител будет свой Fc-рецептор [3]. Таким образом, получается, что разные классы антител эффективны в различных ситуациях. Но для аллергии наибольшее значение представляют IgE.
IgE — это класс антител, которой практически отсутствует в свободном виде в крови здорового человека. Хвостовая часть молекулы имеет высокое сродство к Fc-рецепторам, расположенным на поверхности тучных клеток, базофилов и эозинофилов. Считается, что IgE защищают организм человека от паразитов, а также обусловливают аллергические реакции [3]. Более подробно ознакомиться с антителами можно в статье «Антитело: лучший способ распознать чужого» [19].
Существует теория, что аллергия — это сверхинтенсивная реакция организма на борьбу с паразитами. Такие симптомы, как зуд, чихание, интенсивное выделение слизи и других секретов — не что иное, как механизмы, помогающие избавиться от них.
В современном мире переход к соблюдению норм гигиены предотвращает контакт организма со многими антигенами [4]. Нагрузка на иммунную систему снижается. В таком случае организм начинает реагировать на «безобидные антигены», и возникает аллергия (видео 1) [5]. Антигены, вызывающие аллергию, называют аллергенами. Часто меру аллергической настроенности организма определяют по количеству IgE в крови.
Видео 1. Теория происхождения аллергии
Механизм возникновения аллергической реакции, типы аллергенов
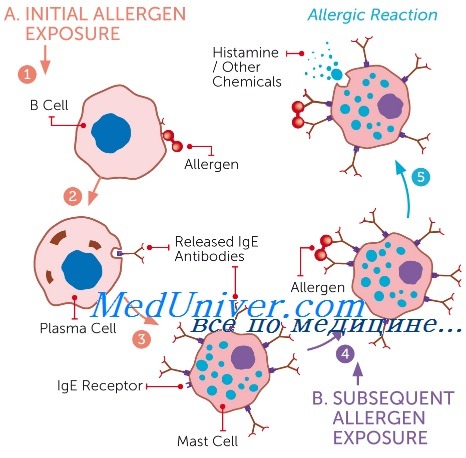
Первая встреча аллергена с иммунной системой стимулирует выработку IgE в кровоток. Эти антитела связываются хвостовой частью с Fc-рецепторами тучных клеток и базофилов. При повторной встрече аллерген связывается с IgE на поверхности тех же самых тучных клеток и базофилов, вызывая их активацию и дегрануляцию (рис.2) [3].
Рисунок 2. Механизм возникновения аллергической реакции
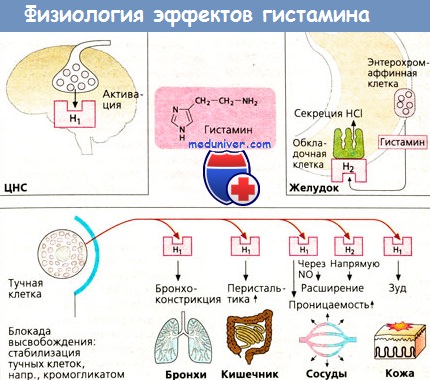
Таким образом тучные клетки и базофилы выделяют в организм человека биологически активные вещества, в том числе гистамин [3]. Гистамин — это биоорганическая молекула, производное аминокислоты гистидина. Гистамин обладает комплексным действием. При попадании в межклеточную среду он сразу же воздействует на стенки капилляров, увеличивая их проницаемость, понижает артериальное давление и вызывает спазм гладкой мускулатуры. Из кровяного русла жидкость выходит в ткани и накапливается там. Образуется отек. Если аллергическая реакция возникла в дыхательных путях, то высвобождение гистамина приведет к резкому спазму бронхов, что является причиной возникновения астмы [3].
В других случаях это приводит к отеку слизистой носа, различных кожных высыпаний, конъюнктивиту. Гистамин также влияет на процесс воспаления, то есть является медиатором воспаления — защитной реакции организма, направленной на устранение патогена и его продуктов жизнедеятельности.
Аллергия может возникнуть практически на любое вещество. Поэтому, для удобства аллергены можно подразделять на группы по происхождению. Это бытовые, лекарственные, эпидермальные (клетки эпидермиса и его производные человека и животных), грибковые, пыльцевые, пищевые и так далее [4].
Одними из сильнейших аллергенов являются представители липид-транспортирующих белков (Lipid Transfer Proteins, LTP) растений. LTP вызывают развитие иммунных реакций на пыльцу и растительные пищевые продукты. Считается, что эти белки играют одну из важнейших ролей в жизнедеятельности растений [6].
Строение и функции LTP
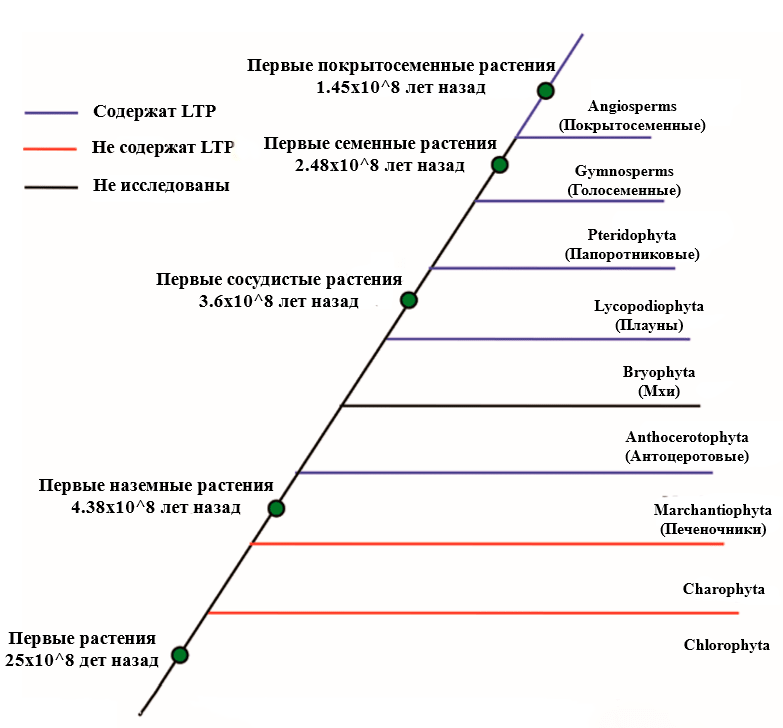
LTP были открыты в 1992 году группой испанских ученых под руководством Рамона Ллеонарта (Ramon Lleonart). Эти маленькие положительно заряженные белки весом около 7–10 кДа обнаружены только у высших растений [6]. У водорослей же они отсутствуют. Возможно, что появление именно этих белков помогло растениям выйти на сушу (рис. 3) [7].
Рисунок 3. Филогенетическое древо, на котором показано наличие или отсутствие LTP в различных группах растений
Выход на сушу и LTP
Выход на сушу требовал развития новых органов, приспособлений и механизмов, чтобы выжить и спокойно существовать в наземной среде. Для ее освоения растениям требовалось решить основную проблему: как защититься от потерь воды. Они нашли выход в виде различных гидрофобных полимеров, формирующих защитный слой на поверхности эпидермальных клеток. Этот слой называется кутикулой. Она защищает от обезвоживания, радиации и даже в какой-то мере от поедания травоядными животными. Образование кутикулы требует транспортировки липидов к месту синтеза на поверхности клетки. Сейчас предполагают, что LTP внесли большой вклад в возникновение и эволюцию кутикулы [8].
Все LTP имеют гидрофобную полость, в которой расположен сайт связывания с гидрофобными молекулами, такими как жирные кислоты, фосфолипиды и др [9].
Помимо гидрофобной полости, структура LTP содержит четыре дисульфидных мостика. Эти четыре связи между атомами серы поддерживают стабильность молекулы в пространстве, придавая ей прочность. Они делают это настолько хорошо, что даже ни ферменты желудочно-кишечного тракта, ни термическая обработка до 100 градусов не могут разрушить белок полностью [9].
Существует несколько типов классификации LTP.
LTP кодируются в растениях мультисемейством генов, в состав которого входят три кластера (3–8 генов в каждом). Белки, кодируемые каждым кластером, характеризуются специализацией по тканям, синтезом на определенной стадии онтогенеза и различием по функциям. Синтез LTP в клетках активируется под влиянием стрессовых факторов и фитогормонов. Стрессовыми факторами могут быть УФ-излучение, осмотический шок, отсутствие влажности, низкие температуры, вторжение различных патогенов [9].
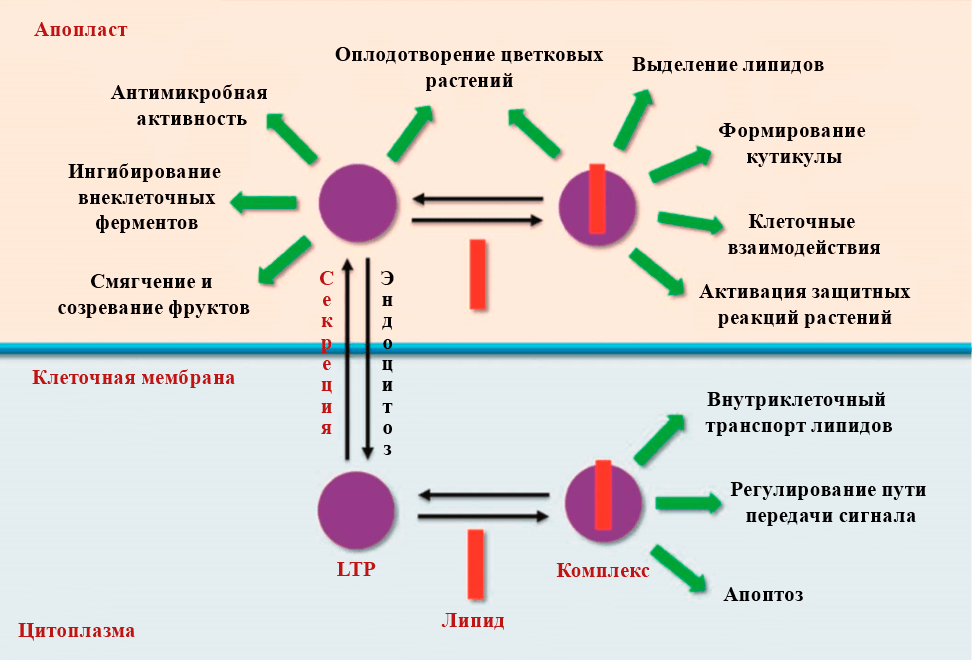
Теперь перейдем к функциям LTP в растениях. Большинство из них основано на проявленных ими активностях в экспериментах in vitro (рис. 4).
Рисунок 4. Функции растительных липид-транспортирующих белков
Было установлено, что LTP способны связывать и переносить липиды через биомембраны в лабораторных экспериментах. Собственно, из этого вытекает одна из предполагаемых функций — перенос гидрофобных молекул, участие в метаболизме липидов [6], [7]. LTP содержатся в высокой концентрации в покровных тканях растений, и это безусловно наталкивает на мысль об их вовлеченности в синтез поверхностного кутикулярного слоя (рис. 5) [9]. У мутантов растений Brassica napus с повышенным синтезом белка BrLTPd1 наблюдается нарушение секреции воска [8].
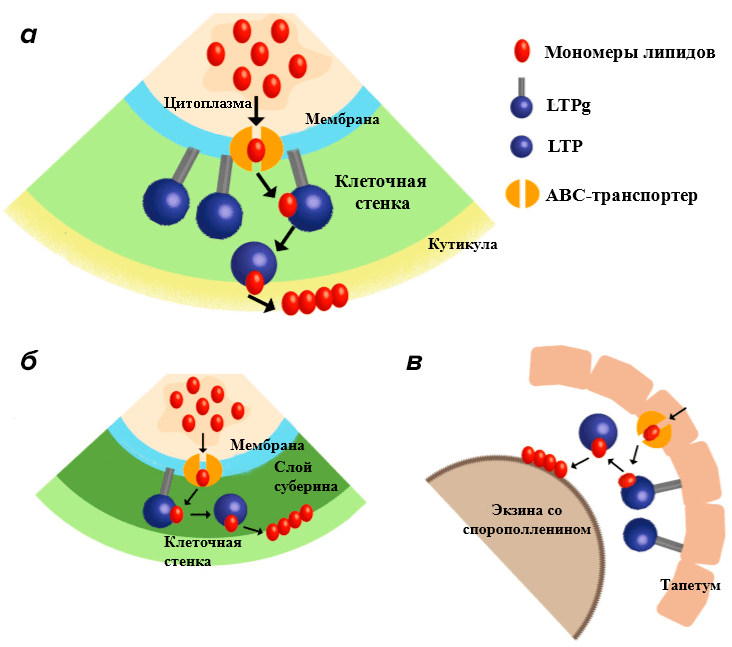
Рисунок 5. Предполагаемый механизм переноса липидов через мембрану и их участие в синтезе кутикулы. а — В зеленых тканях. б — В корнях. в — В пыльце.
Это происходит так: мономеры липидов через специальный ABC-транспортер попадают в пространство клеточной стенки. Там происходит их связывание с прикрепленными к наружней стороне мембране LTPg. Те, в свою очередь, передают липид на свободный LTP, который транспортирует гидрофобную молекулу в место синтеза кутикулы. Но до сих пор остается неясным механизм переноса липида по клеточной стенке [9].
Многие LTP препятствуют росту патогенных бактерий и грибов. Чаще всего такие взаимодействия являются избирательными, скорее всего, это связано с разным составом липидов в клеточных мембранах бактерий, грибов, млекопитающих и растений. Также некоторые исследования отмечают, что LTP из перца и кофе подавляют активность грибов рода Candida, которые являются патогенами человека. Механизм такой антимикробной активности не ясен. Возможно, он обеспечивается за счет электростатических взаимодействий с мембранами патогенов. Есть данные, что при разрушении дисульфидных мостиков антимикробная активность пропадает, поскольку нарушается процесс связывания белков с липидами. В то же время, антимикробная активность никак не связана с процессами взаимодействия с гидрофобными молекулами [9].
LTP в пищевой промышленности
Свойство LTP связываться с гиброфобными молекулами активно используется в пивоварении. LTP ячменя обладает поверхностно-активными свойствами, однако до термообработки и пастеризации пива этот белок демонстрирует слабые свойства вспенивания. После пастеризации пива LTP ячменя модифицируется по неисследованному механизму и становится пенообразующим [10]. При пастеризации его антимикробная активность не нарушается, в результате чего увеличивается срок хранения, поскольку LTP способен подавлять рост дрожжей. LTP также связывает жиры, что в лучшую сторону сказывается на формировании пены (рис. 6) и на вкусе пива [9].
Рисунок 6. Пена
И еще одно интересное свойство у определенных LTP, не связанное с аллергией, выявленное в ходе экспериментов, — это наличие противораковой активности [9]. Проведенные исследования показали, что LTP из полевой капусты и нарцисса препятствуют размножению и пролиферации раковых клеток in vitro, а также подавляют активность респираторно-синцитиального вируса человека и ВИЧ (механизм остается неизвестным) [11]. Остальные функции LTP (рис. 4) изучены очень слабо и в этой статье рассматриваться не будут.
LTP — аллергены
LTP обладают аллергенностью — способностью вызывать аллергию, что напрямую связано с особенностями их структуры. Четыре дисульфидных мостика обеспечивают устойчивость к разрушению ферментами желудочно-кишечного тракта. Получается, что LTP попадают в неизменном виде в тонкий кишечник и затем через ворсинки всасываются в кровь, где встречаются с иммунной системой человека [9]. В отличие от других аллергенов, 40% поверхности LTP способно связываться с иммуноглобулинами. Часто у страдающих пищевой аллергией на LTP может проявляться LTP-синдром, заключающийся в перекрестных аллергических реакциях на LTP различных видов растений, в том числе и таксономически далеких [12].
Был описан интересный случай на одном из складов в Европе. Работа сотрудников требовала ежедневного контакта с персиками. Известно, что кожура персиков содержит высокую концентрацию растительных липид-транспортирующих белков, а LTP Pru p 3 — это один из самых распространенных пищевых аллергенов. Через какое-то время один из служащих начал страдать ринитами. А через шесть месяцев у него возникла тяжелая пищевая аллергия на персики, сливы, фундук, арахис и т.д. Исследователи сделали вывод, что контакт пациента с кожурой персика мог спровоцировать возникновение аллергической чувствительности через дыхательные пути и дальнейшее развитие пищевой аллергии [12].
По данным Европейской академии аллергии и клинической иммунологии, 150 миллионов европейцев страдают от хронической аллергии. Из них у семи миллионов обнаруживается пищевая аллергия, а 100 миллионов в той или иной степени столкнулись с аллергическими ринитами [13]. В Испании 11% людей имеют аллергию на пыльцу. Из них от 10% до 40% также имеют аллергию на LTP персика [14].
В Северной Европе аллергия на LTP чаще всего представлена в виде оральной аллергии на входящий в состав пыльцы березы белок Bet v 1. А от пищевой аллергии на LTP больше страдают жители Средиземноморья [12].
Такое неравномерное географическое распределение до сих пор обсуждается, поскольку растительные продукты в Северной Европе также имеют высокое содержание LTP, однако частота возникновения аллергии на них значительно ниже. Возможное объяснение — это разные диетические привычки и способы термической обработки продуктов [12].
Методы лечения аллергии
Одним из самых простых и действенных методов борьбы с аллергией является, конечно же, ограничение контакта с аллергеном. В случае аллергии на пыль необходимо использовать воздушные фильтры для очистки воздуха, в случае пищевой аллергии — перестать употреблять продукт.
Для того чтобы не заставлять больного полностью исключать аллергенный продукт из рациона, можно методами генной инженерии разработать его гипоаллергенные аналоги. Так, уже созданы генномодифицированные томаты с LTP, измененные с помощью методов сайт-направленного мутагенеза и химических модификаций. Модифицированные белки снизили аллергическую реакцию при кожных тестах у пациентов [12].
Для избавления от симптомов аллергии, в том числе вызванных LTP, применяют фармакотерапию. Используемые для этого средства можно разделить на три группы.
К первой относится лечение антигистаминными препаратами. Действующие вещества блокируют рецепторы, с которыми связывается гистамин и, следовательно, препятствуют развитию аллергической реакции. Они не подходят для лечения аллергии в долгосрочной перспективе. Антигистаминные препараты обладают побочными эффектами, например, сонливостью, негативно влияют на сердечную мышцу [15].
Другая группа препаратов воздействует на мембраны тучных клеток, блокируя выброс везикул с гистамином. Это устраняет отеки слизистой носа и предупреждает появление астмы. Но опять же механизм работы направлен на блокирование симптомов, что не решает проблему полностью.
При серьезных случаях для быстрого облегчения острых симптомов принимают препараты на основе глюкокортикоидов — гормонов надпочечников. Глюкокортикоиды обладают противовоспалительной активностью [15].
Однако на данный момент одним из самых эффективных методов борьбы с аллергией является аллергенспецифическая иммунотерапия. Этот метод основан на продолжительном введении одного аллергена пациенту для постепенного уменьшения восприимчивости [16]. Его применяют при аллергии на LTP арахиса, персика, фундука, вишни и т.д. [17]. Подробности механизма действия, эффективность работы описаны в статье «Как победить аллергию за четыре инъекции?» [16].
Эффективность данной терапии налицо, но доказано, что такое лечение сопровождается анафилактическими побочными эффектами. Для их предотвращения в случае LTP разрабатывают замены экстрактов LTP на гипоаллергенные рекомбинантные аналоги [17].
Также врачи в качестве лечения назначают сублингвальную терапию. Данная терапия очень похожа по принципу действия на аллергенспецифическую, а отличие в том, что здесь используются не один, а несколько аллергенов [17], [18]. В этом методе пациенту индивидуально подбирают «коктейль» из аллергенов, которые наносится под язык каждый день по нескольку капель в течение продолжительного времени (3–5 лет). В результате спустя какое-то время организм пациента перестает остро реагировать на контакт с этими аллергенами [17], [18]. С помощью этой терапии борются с аллергией на LTP персиков, абрикосов, груш, слив и др. [12].
Растительные липид-транспортирующие белки, без сомнения, интересный биологический объект для изучения аллергической реакции, как с фундаментальной, так и с практической точки зрения. Бóльшая часть механизмов их действия на организм человека до сих пор не исследована, а точные функции в растениях не установлены. Количество людей, страдающих от аллергии на LTP, увеличивается с каждым годом, что указывает на необходимость их активного изучения. Кто знает, к каким новым открытиям могут привести эти маленькие катионные белки!