rec что значит в медицине
Rec что значит в медицине
1. Сокращения:
• Критерии оценки ответа солидных опухолей на лечение (RECIST)
2. Определение:
• Новая версия критериев была опубликована в 2009 г.
• Используются модифицированные критерии RECIST
3. Ключевые принципы:
• Критерии включения пациентов:
о Пациенты с наличием измеряемых проявлений заболевания при первичном исследовании
— Наличие как минимум одного измеряемого очага
о Первичной конечной точкой является оценка объективного ответа опухоли на лечение
• Оценка опухоли при первичном исследовании:
о Обнаружение измеряемых проявлений заболевания
о Выбор целевых и нецелевых очагов
о Измерение целевых очагов
о Опухолевая нагрузка: сумма размеров целевых очагов
• Оценка опухоли при повторном исследовании:
о Измерение целевых очагов
о Оценка нецелевых очагов
о Обнаружение новых очагов
о Расчет ответа опухоли на лечение в данной временной точке
4. Существенные различия между RECIST и RECIST 1.1:
• Внесены изменения в определения следующих понятий:
о Опухолевая нагрузка
о Размер лимфатических узлов
о Прогрессирование заболевания
о Прогрессирование неизмеряемых проявлений заболевания о Подтверждение ответа о Новые очаги



б) Лучевая анатомия:
1. Измеряемые и неизмеряемые проявления заболевания:
• Измеряемые проявления:
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным при КТ или МРТ в аксиальной плоскости с интервалом реконструкции 5 мм LD должен превышать толщину среза как минимум в два раза
о Опухоль с наибольшим диаметром (LD) >20 мм, измеренным при рентгенографии органов грудной клетки (если очаг имеет четкий контур и окружен воздушной легочной тканью)
— Предпочтительнее проводить КТ
о Опухоль с наибольшим диаметром (LD) > 10 мм, измеренным клинически (по фотографии) электронным штангенциркулем:
— На фотографиях на кожных покровах следует располагать линейку
— Образования, размер которых не удается с точностью определить с помощью штангенциркуля, следует считать неизмеряемыми
о Размер лимфатических узлов по короткой оси при КТ должен составлять > 15 мм (толщина среза 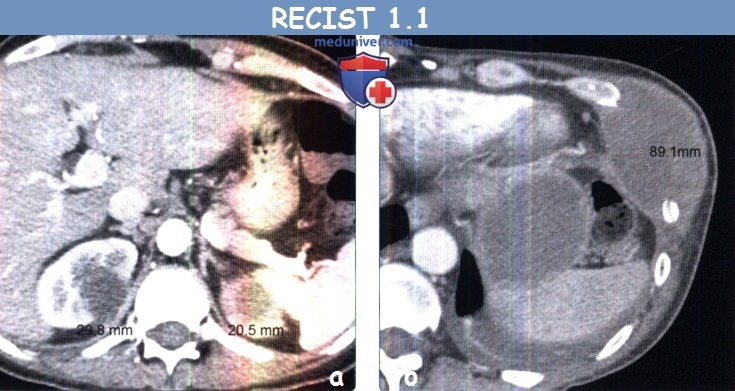
(б) Мужчина 47 лет с метастазами немелкоклеточного рака легкого. При КТ с контрастным усилением в грудной стенке визуализируется метастаз. В соответствии с RECIST 1.1 метастазы в костях считаются целевыми очагами только в том случае, если содержат мягкотканный компонент, отвечающий критериям размера. 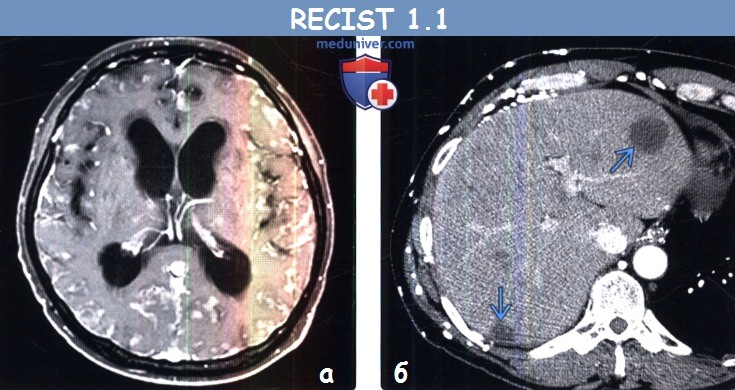
(б) Мужчина 4 7 года с метастазами муцинозной аденокарциномы легкого. При КТ с контрастным усилением в печени визуализируется гиподенсный кистозный метастаз, расцененный как измеряемый очаг. 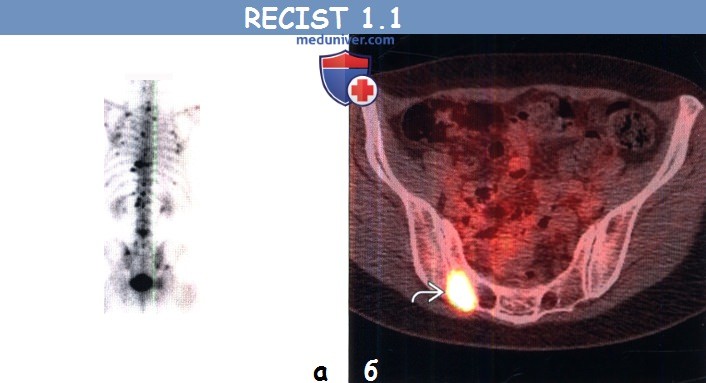
(б) Пациент, страдающий немелкоклеточным раком легкого. При ФДГ-ПЭТ/КТ в правой половине крестца визуализируется очаг с повышенным уровнем поглощения ФДГ. При КТ в данной области патологический участок не выявлен. Остеосцинтиграфия и ПЭТ/КТ могут быть использованы для обнаружения метастазов в костях, но не для их измерения.
1. Ключевые принципы:
• Измерение ранее выбранных целевых очагов (даже если их размер перестал быть наибольшим)
• Оценка всех ранее выбранных нецелевых очагов
• Оценка новых очагов
2. Оценка целевых очагов:
• Расчет SLD:
о Измерение LD каждого целевого очага
о Измерение размера целевых лимфатических узлов по короткой оси
о Если размер образования слишком мал для того, чтобы быть измеренным, считают, что его размер составляет 5 мм (величина по умолчанию)
о Если образование исчезло, считают его размер равным 0
о Распадающиеся или сливающиеся очаги:
— Если целевой очаг распадается на множество меньших по размеру фрагментов, то суммируются LD всех фрагментов
— Если целевые очаги сливаются, то используется LD конгломерата
3. Новые очаги:
• Новые очаги должны быть исключительно опухолевой этиологии:
о Сомнительные очаги, возникновение которых обусловлено разницей в методиках исследования или потенциально неопухолевым процессом, не учитывают
о Не обязательно должны быть измеряемыми
• Сомнительные очаги:
о Оценивают повторно при исследовании в следующей временной точке
о Если наличие очага подтверждается при повторном исследовании, то регистрируется прогрессирование заболевания по дате первого выявления такого очага
• Очаги, обнаруженные за пределами зоны первичного исследования, считают новыми
• Наличие новых очагов, выявленных при УЗИ, следует подтвердить с помощью КТ или МРТ
4. Общий ответ:
• Категории:
о Полный ответ (CR)
о Частичный ответ (PR) о Стабилизация заболевания (SD)
о Оценка невозможна (NE) о Прогрессирование заболевания (PD)
5. ФДГ-ПЭТ и ПЭТ/КТ:
• Критерий «положительного» результата при ПЭТ:
о Уровень поглощения ФДГ образованием в два раза превышает уровень поглощения ФДГ окружающими тканями при выполнении исследования с коррекцией аттенуации сигнала
• Влияние на категории ответа:
о Отрицательный результат при первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания (новый очаг)
о Отсутствие первичной ПЭТ и положительный результат при повторной ПЭТ: прогрессирование заболевания:
— Требует подтверждения наличия очага по данным КТ
При подтверждении наличия очага регистрируется прогрессирование заболевания по дате выполнения первой ПЭТ
о Ключевая особенность:
— При отсутствии первичной ПЭТ и положительном результате повторной ПЭТ наличие выявленного ранее при КТ очага без признаков прогрессии не следует расценивать, как прогрессирование заболевания
6. Ошибочная оценка и случаи, когда оценка невозможна:
• NE: все очаги не могут быть оценены в определенной временной точке:
о Обычно причиной служит потеря данных или низкое качество изображений
о Также данная категория ответа соответствует невозможности оценки некоторой части очагов:
— Исключение: если данные очаги не повлияют на оценку ответа на лечение в определенной временной точке
7. Рецидивирование очагов:
• Влияние рецидивирования очагов зависит от общего ответа:
о Стабилизация заболевания/частичный ответ:
— Образование, подвергшееся обратному развитию, а затем рецидивировавшее, продолжает учитываться
— Категория ответа зависит от состояния других очагов
о Полный ответ
— Рецидивирования образования свидетельствует о прогрессировании заболевания
8. Подтверждение ответа на лечение:
• Частичный ответ/полный ответ:
о Подтверждение необходимо в случае нерандомизированных клинических исследований, в которых эффективность лечения является первичной конечной точкой
о В случае стабилизации заболевания в первой промежуточной точке допускается последующее подтверждение частичного ответа
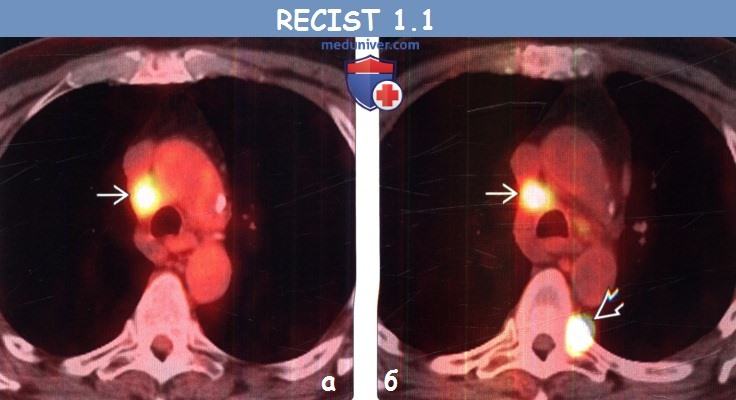
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ уровень поглощения ФДГ правым паратрахеальным лимфатическим узлом остался без изменений, однако в грудном позвонке возник новый интенсивно накапливающий ФДГ метастаз, что соответствует прогрессированию заболевания. 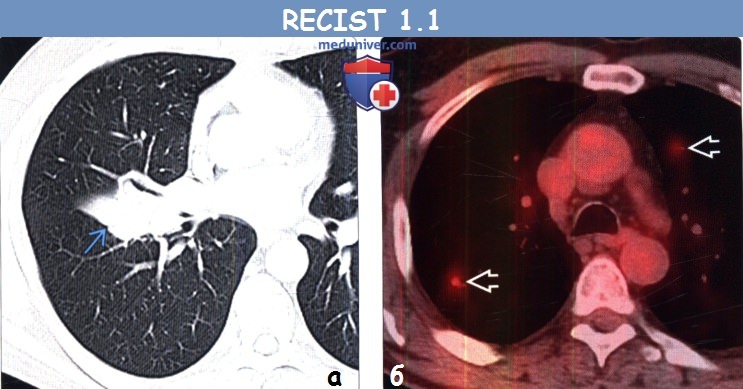
(б) У этого же пациента после курса химиотерапии при ФДГ-ПЭТ/КТ в легких визуализируются новые интенсивно поглощающие ФДГ узелки, соответствующие метастазам. Поскольку данные метастазы при первичной КТ не выявлялись, а при последующей КТ их наличие было подтверждено, то картина соответствует прогрессированию заболевания. 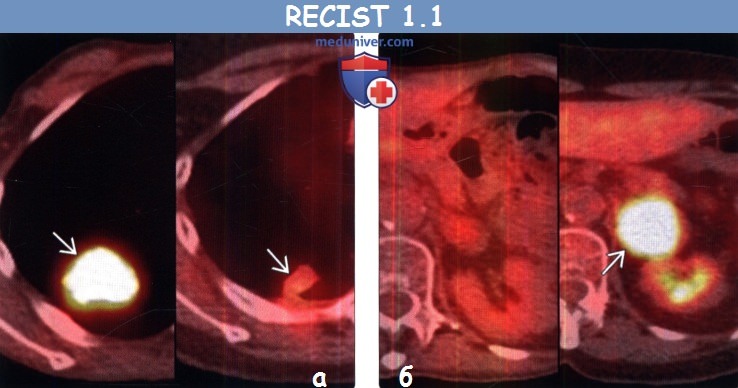
(б) У этого же пациента на совмещенных изображениях при первичной ФДГ-ПЭТ/КТ (слева) и после курса химиотерапии (справа) визуализируется возникновение интенсивно поглощающего ФДГ метастаза в левом надпочечнике, что соответствует прогрессированию заболевания.
в) Список литературы:
1. Litiere S et al: The components of progression as explanatory variables for overall survival in the Response Evaluation Criteria in Solid Tumours 1.1 database. Eur J Cancer. 50(10)4847-53, 2014
2. Nishino M et al: Revised RECIST guideline version 1,1: What oncologists want to know and what radiologists need to know. AJR Am J Roentgenol. 195(2):281-9, 2010
3. van Persijn van Meerten EL et al: RECIST revised: implications for the radiologist. A review article on the modified RECIST guideline. Eur Radiol. 20(6)4 456-67, 2010
4. Eisenhauer EA et al: New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer, 45(2):228-47, 2009
5. Eisenhauer EA et al: Response assessment in solid tumours (RECIST) and supporting papers (version 14). Eur J. Cancer. 45(2):225-310, 2009
Редактор: Искандер Милевски. Дата публикации: 24.2.2019
Перитонеальный канцероматоз
Перитонеальный канцероматоз
Вам поставили диагноз: перитонеальный канцероматоз (опухоль брюшины)
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Причины возникновения перитонеального канцероматоза
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
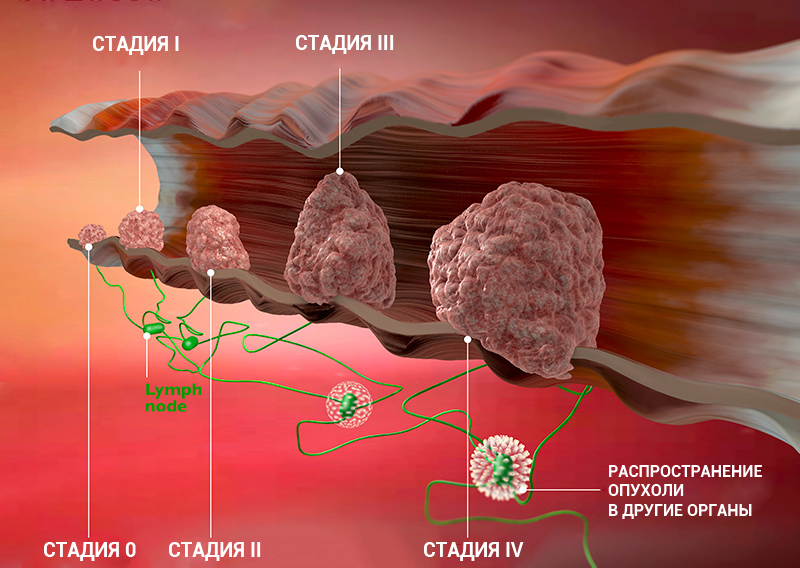
Стадии рака: классификация онкологических заболеваний
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Например, с нейроэндокринным раком поджелудочной железы люди могут жить десятилетиями, а при метастатической стадии рака поджелудочной железы — полгода или год, — объясняет врач-онколог.
Что может повлиять на прогноз людей с одинаковой стадией и одним видом рака?
Сергей Югай выделяет три фактора: