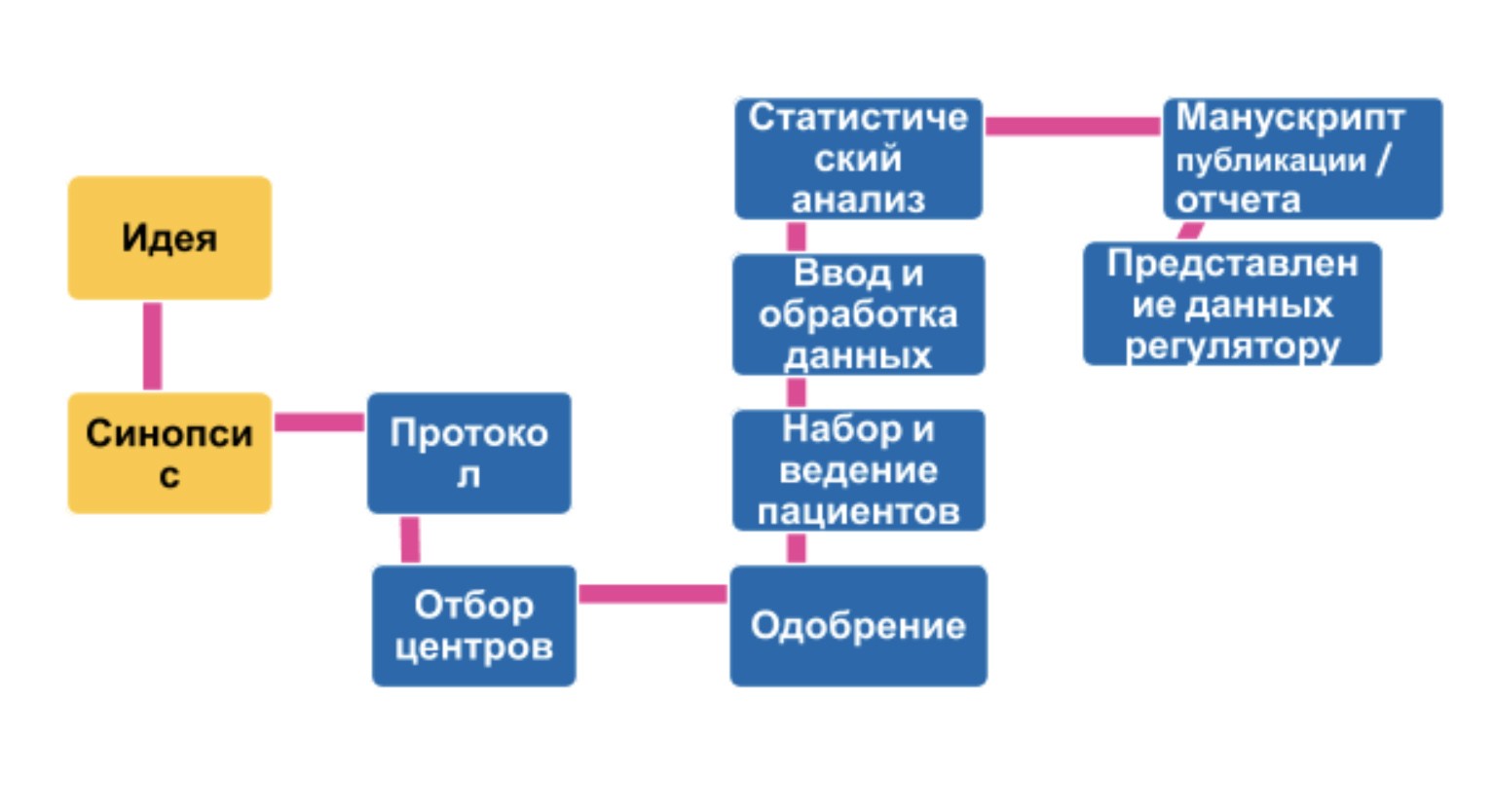
Что значит клинические исследования вакцины
Чем на самом деле является вакцина от коронавируса? Испытания, скрытые компоненты и правда о сроках разработки «Спутник V»
Чем на самом деле является вакцина от коронавируса? Испытания, скрытые компоненты и правда о сроках разработки «Спутник V»

Институт им. Гамалеи, где и был синтезирован «Спутник V», создавал вакцины на основе аденовируса с 2015 г., поэтому ученым в относительно небольшие сроки удалось создать вакцину от коронавируса. Она защищает организм от заражения следующим образом: в аденовирусный вектор (вирус), который искусственно лишили возможности размножаться, вшили ген, кодирующий S-белок шипа коронавируса. Вектор доставляет кусочек РНК-вируса в клетку, а та, в свою очередь, реагирует на это так же, как реагировала бы на вторжение SARS-CoV-2. Начинают вырабатываться специфические антитела, которые и создают иммунитет против коронавируса.
Что входит в состав вакцины от коронавируса и содержатся ли в ней опасные «ингредиенты»?
Аденовирусный вектор – основное действующее вещество вакцины. Это главное составляющее, но, для работы прививки необходимы и другие компоненты. Они помогают сохранить эффект действующего вещества и облегчают его проникновение в клетки человека.
Помимо самого аденовирусного вектора в состав «Спутник V» входят:
Каждый «ингредиент» прививки от коронавируса абсолютно безвреден. Для того чтобы проверить, формируют ли в связке все эти компоненты устойчивый иммунитет к коронавирусу, проводятся испытания.
Какие испытания прошла вакцина от коронавируса?
Сразу после синтеза нового препарата, ученые провели доклиническое тестирование на хомячках и приматах. Проверяли токсичность, безопасность и эффективность новой вакцины. Никаких осложнений, побочных реакций у животных не возникло, поэтому ученые приступили к клиническим испытаниям на людях.
Первая фаза испытаний обычно проводится на небольшой группе здоровых добровольцев. Для тестирования российской вакцины «Спутник V» было привлечено 76 военных возрастом от 18 до 60 лет. Фаза была разделена на два этапа.
Первый этап длился 28 дней. Девятнадцати добровольцам поставили первую часть вакцины, основанной на ослабленном аденовирусе 26 типа, другим девятнадцати – вторую, с аденовирусом 5 типа. Так была проверена безопасность обоих компонентов вакцины. Результатом этапа стала хорошая переносимость препарата всеми добровольцами. Побочные эффекты были легкими или умеренными:
Опасных для жизни побочных эффектов обнаружено не было.
Во время второго этапа исследовался уже формирующийся после вакцинации иммунитет. Все добровольцы получили обе части вакцины с разницей в 21 день между ними. На 28 день после введения второй дозы, с помощью высокоточных тестов, у 100% добровольцев были обнаружены антитела к SARS-CoV-2. Более того, было доказано формирование другого – клеточного иммунитета. Обычно он сохраняется в «памяти» организма несколько лет.
Спустя три месяца после старта третьей фазы клинических испытаний в декабре 2020 г. российский Минздрав принял решение совместить последний этап исследований с массовой вакцинацией населения прививкой «Спутник V». Решение приняли оперативно, основываясь на предварительных результатах, опубликованных разработчиками вакцины в ноябре 2020 г.
В основе проведенных расчетов лежат случаи заболевания COVID-19 среди уже привитых добровольцев. Из общего числа участников испытаний, получивших обе положенные инъекции вакцины или плацебо (18 794), к концу третьей недели после второго укола вирус был диагностирован у 39 человек.
31 случай заражения был выявлен у тех, кто получил плацебо. В группе волонтеров, привитых настоящей вакциной, COVID-19 был диагностирован у восьмерых (группа получивших вакцину – в три раза больше группы плацебо). Сопоставление результатов по двум группам дает результат эффективности вакцины в 95%.
«Набранная группа участников исследований позволяет в полной мере исследовать профиль безопасности и профилактической эффективности вакцины на длительном промежутке времени», – пояснили в Минздраве.
Несмотря на то, что прививка «Спутник V» стала доступна всем желающим (за исключением группы с противопоказаниями), ученые продолжили наблюдение за добровольцами, принявшими участие в третьей фазе клинических испытаний. Второго февраля 2021г. разработчики вакцины представили результаты исследования в авторитетном медицинском издании The Lancet.
Результаты последней третьей фазы клинических испытаний вакцины «Спутник V»
Третья фаза испытаний вакцины «Спутник V» длилась с 7 сентября по 24 ноября. В ней приняли участие 21 977 человек, из них 16 427 были привиты, а 5435 – получили плацебо (раствором, в который входят все ингредиенты «Спутник V», кроме самого аденовирусного вектора).
Согласно выводам ученых специфические антитела против коронавируса вырабатывались через 42 дня после первой прививки или через 21 день после второй у 95,8% добровольцев. Более того, в день первой инъекции и через 28 дней после второй у добровольцев уже определялся клеточный иммунитет.
Что касается побочных эффектов, они проявились у 7966 привитых, при этом у 94% из них были легкими и включали повышение температуры, неприятные ощущения в месте инъекции, головную боль и слабость. Лишь 0,3% привитых имели серьезные побочные эффекты, однако, независимая комиссия не доказала связи между ними и вакцинацией.
Эффективность вакцины при таких показателях составляет 91.6%.
«Спутник V» также исследовали на добровольцах старше 60 лет – всего 2144 человека. Эффективность вакцины в этой группе практически не отличается от общей и составляет 91.8%.
Таким образом, вакцина показала свою эффективность и безопасность как у людей от 18 до 60 лет, так и у пожилых добровольцев. При этом серьезных побочных эффектов, связанных с вакциной, обнаружено не было.
Быстро не значит плохо: почему вакцину от коронавируса разработали за короткие сроки?
Разработка и тестирование вакцины заняли около года. Это уникальный, но объяснимый, случай. Прежде всего, ускорило создание «Спутник V» то, что вакцина была сделана на основе аденовирусного вектора. Такая технология уже давно известна ученым, а сам центр им. Гамалеи имел опыт в выпуске подобных вакцин. Ранее была разработана вакцина от ближневосточного респираторного синдрома. Вирус, который его вызывает – MERS, также относится к группе коронавирусов.
Быстрое распространение и способность к мутации вируса требовали кардинальных решений. При этом безопасность и эффективность вакцины на первом месте. Именно поэтому первые фазы исследования были проведены с соблюдением всех международных правил: количество добровольцев на каждой фазе, критерии оценки их состояния здоровья после вакцинации. Только после того, как вакцина показала свою безопасность и способность защищать от коронавируса, было принято решение о массовой вакцинации.
Как изменится мир после массовой вакцинации?
Идея коллективного иммунитета заключается в том, что, когда достаточно большое число людей в популяции уже обладает иммунитетом, инфекция лишается каналов распространения. Из-за этого вспышки заболевания быстро сходят на нет. Добиться коллективного иммунитета против коронавируса можно только путем вакцинации.
После массовой вакцинации будет снижена нагрузка на медицинский персонал и больницы, многие люди, особенно те, которые находятся в группе риска, смогут вернуться к привычной жизни. Вакцинация не только положит конец пандемии, но и поможет не бояться новых вспышек коронавируса.
Началась третья фаза клинических исследований вакцины от Covid-19. Разбираемся, что это значит
— Что именно называют клиническими исследованиями? Это весь процесс разработки лекарства или какая-то его часть?
— Клинические исследования — это фаза, предшествующая регистрации и лицензированию лекарственного средства.
Сначала ведут поиск потенциальных молекул. Затем их эффективность и безопасность оценивают в лабораторных условиях на клеточных культурах или животных, что регулируется международными правилами. Если молекула показала положительные результаты на этапе доклинических исследований, препарат начинают оценивать в клинических исследованиях.
Клинические исследования до регистрации проходят три фазы. И в случае положительных результатов формируют досье для регистрации, которое подают в государственные органы.
Редко, но бывают ситуации, когда компания-разработчик считает результаты положительными, но государственные органы или наднациональные международные структуры — в России это Минздрав, в США — Food and Drug Administration (FDA), в Европейском союзе — European Medicines Agency (EMA) — признают данные недостаточными для регистрации лекарственного средства.
— Какой процент лекарств со стадии разработки доходит до пациента?
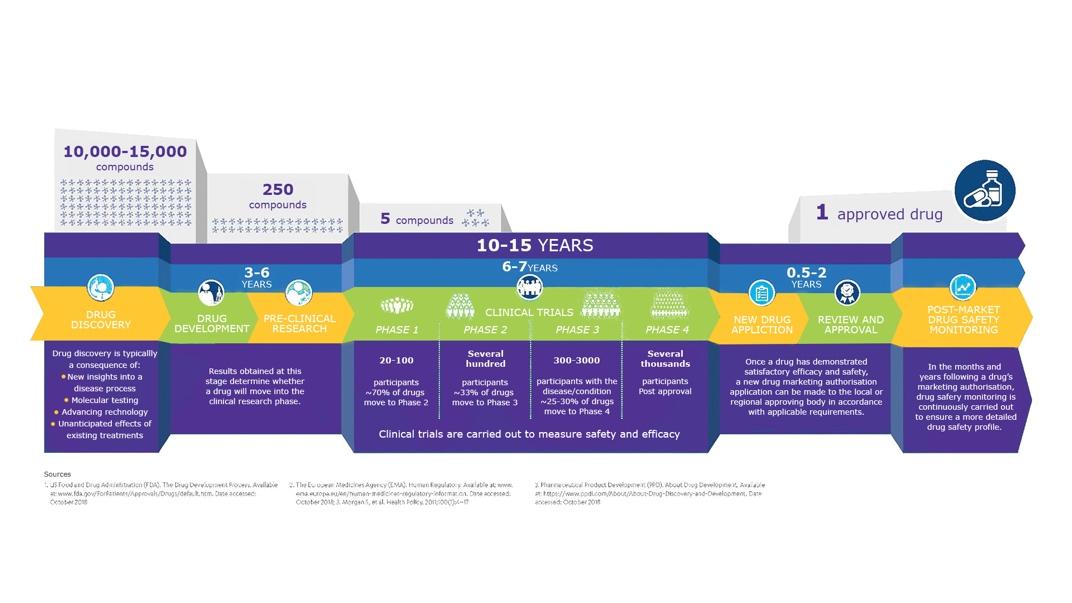
— Из 10–15 тысяч потенциальных молекул регистрируется всего одна. Поиск новых препаратов ведут, в первую очередь, исходя из нерешенных клинических вопросов. В последнее время при поиске и разработке новых лекарственных средств используют большие массивы данных и искусственный интеллект.
До стадии доклинических исследований из 10–15 тысяч молекул доходят в среднем 250. Доклинические исследования длятся 3–6 лет, и в среднем пять молекул из 250 выходят на клинические исследования.
Клинические исследования имеют четыре фазы. Первая фаза проходит на здоровых добровольцах. Ее цель — подтвердить безопасность препарата для человека, а также собрать данные по фармакокинетике. В среднем, она длится 1–2 года, в ней участвуют 20–80 пациентов.
Во второй фазе лекарственный препарат назначают уже пациентам с заболеванием, для лечения которого он разрабатывается. Вторая фаза занимает не менее 2–3 лет с участием 80–100 пациентов, и в ходе данной стадии оцениваются эффективность и безопасность, а также определяются минимальная эффективная доза и оптимальный режим дозирования.
В третьей фазе действие исследуемого препарата сравнивают со стандартным лечением. Она занимает 3–4 года и в ней участвуют 1000–4000 пациентов.
Четвертая фаза проводится после регистрации препарата и обычно ставит своей целью получение дополнительных данных как в контролируемых условиях, так и в условиях обычной клинической практики.
Из пяти лекарственных препаратов, дошедших до клинических исследований, регистрируется только один. Процесс регистрации занимает от 1,5 до 2 лет.
Таким образом, с момента поиска новой молекулы до его регистрации проходит 10–15 лет.
От трагических последствий — к единым правилам
— Как появились современные нормы проведения клинических исследований?
— В первую очередь, внимание уделялось этическим принципам проведения исследований. Правила формулировались в течение всего XX века — в основном, как результат трагических последствий отсутствия должного регулирования.
Первый такой пример — эликсир сульфаниламида, поступивший в продажу в 1937 году. Сам сульфаниламид — один из первых антибиотиков — успешно использовался и до этого, но производитель предложил новую удобную форму — сироп на основе диэтиленгликоля со вкусом малины. К сожалению, выбранный растворитель оказался чрезвычайно токсичным. Он вызывал острую печеночную и почечную недостаточность и привел к смерти первых же пациентов.
В результате уже в 1938 году конгресс США принял федеральный акт о пищевых продуктах, лекарственных средствах и косметике. Он предоставил государству контроль над разработкой лекарственных препаратов.
Следующим важным шагом стал Нюрнбергский кодекс 1947 года. Он стал ответом на бесчеловечные опыты на людях, которые проводились во время Второй мировой войны, и закрепил этические нормы обращения с пациентами в процессе клинических исследований.
В 1961 году была еще одна драматическая страница — вокруг уже испытанного лекарства — талидомида. Он обладал снотворным действием, и его начали прописывать беременным женщинам. Оказалось, что препарат был с тератогенным эффектом и приводил к врожденным уродствам.
Все эти печальные страницы истории привели к появлению в 1964 году Хельсинкской декларации Всемирной медицинской ассоциации (ВМА).
— Так как можно и как нельзя работать с испытуемым с точки зрения этических принципов?
— Основополагающим документом в вопросах этики медицинских экспериментов является Хельсинкская декларация. Она адресована врачам и призывает других лиц, вовлеченных в медицинские исследования с участием человека в качестве субъекта, следовать этим принципам. Последние изменения были внесены на 64-ой ассамблее ВМА в Форталезе в 2013 году.
Ниже приведены основные принципы Хельсинкской декларации :
Польза от лечения должна быть выше рисков
— С какой целью проводятся клинические исследования?
— Клинические исследования проводятся, чтобы понять причины заболевания и механизмы его развития, а также совершенствовать его профилактику и терапию.
Но долг врача всегда — это защита здоровья и жизни человека и не только. Врач с должной этической и научной подготовкой понимает, что в зоне его ответственности также неприкосновенность личности пациента, его право в любой момент отказаться от лечения, его частная жизнь и конфиденциальность персональных данных.
Поэтому цель исследования никогда не может быть важнее прав и интересов его участников.
Пациентов привлекают только тогда, когда это оправдано с точки зрения их здоровья: риск не может быть выше, чем ожидаемая польза от лечения.
Специальные страховки гарантируют компенсацию и лечение участникам клинических исследований.
— А как понять, успешно ли исследование?
— Исследование конструируется таким образом, чтобы можно было сравнить предлагаемую терапию с наилучшей имеющейся на данный момент терапией или с плацебо, если таковой нет.
Также важно отметить, что современные нормы обязывают производителей публиковать все результаты исследований — не только положительные, но и отрицательные или нейтральные.
Важно, что с этической точки зрения исследование не должно проводиться повторно, если получены убедительные результаты. Тем самым минимизируются риски для пациентов, удается избежать «избыточного» числа исследований.
— Как регулируется проведения исследования?
— Для этого сегодня существует стандарт, который называется «Качественная клиническая практика» (GCP — Good Clinical Practice). Это международный стандарт, который позволил гармонизировать правила разных стран, то есть сделать их универсальными.
Это был большой шаг вперед — странам стало не нужно отдельно набирать свои когорты пациентов, причем произошло это без ущерба для качества исследования. Правила GCP были утверждены в ЕС и США в 1997 году, а в России принципы GCP были введены в 2005 году в ГОСТ Р 5279-2005 «Надлежащая клиническая практика».
Эти стандарты регулируют не только планирование и проведение исследований с участием человека, но и документальное оформление и представление результатов исследований. Последнее очень важно, потому что именно на основе этих документов государственные органы принимают решение о регистрации лекарственного препарата.
Синим помечены этапы, которые регулирует GCP стандарт
— Что гарантирует соблюдение стандарта «Качественная клиническая практика»?
— Соблюдение прав пациента и достоверность результатов исследований.
Это означает, что если после одобрения препарата в рамках обычной клинической практики доктора будут использовать его в соответствии с зарегистрированной инструкцией, то результаты будут сопоставимыми с результатами, полученными при клинических исследованиях.
— Как добиваются соблюдения этих правил?
— Любое клиническое исследование проходит две независимых экспертизы — научную и этическую.
Исследование рассматривает этическая комиссия. В ней должно быть не менее пяти человек, хотя бы один из них должен иметь квалификацию вне зоны медицины и еще один — не иметь отношения к организации, проводящей исследования.
Каждый пациент перед началом исследования подписывает форму информированного согласия, где подробно и понятно описаны цели исследования, права пациента, риски и ряд других стандартных пунктов. Важно, что пациент в любой момент может отозвать информированное согласие без объяснения причин. Тем самым подтверждается принцип добровольного участия любого пациента.
Вакцинация как медицинский эксперимент. Правовые гарантии неучастия
Авторы: Дмитрий Казаков, Виталина Степанова, Кристина Табакина
В связи с проведением массовой вакцинации от COVID-19 актуальным представляется вопрос об условиях клинических испытаний лекарственных препаратов и их особенностях для отдельных категорий, участвующих в испытаниях граждан.
Вакцина, безусловно, является лекарственным препаратом в соответствии с определением, закрепленным в пункте 1 статьи 4 Федеральный закон № 61-ФЗ « Об обращении лекарственных средств», поскольку является веществом, вступающим в контакт с организмом человека или животного, проникает в органы, ткани организма и применяется для профилактики заболевания.
На данный момент ни одна из отечественных вакцин не прошла все фазы клинических испытаний ( см.: Реестр разрешений на проведение клинических исследований Государственного реестра лекарственных средств).
Под клиническим испытанием лекарственного препарата понимается изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и ( или) пищевыми продуктами. [1]
Главное отличие клинического испытания от доклинического исследования заключается в том, что испытуемыми являются не животные, а люди.
Согласно статье 39 Федерального закона « Об обращении лекарственных препаратов» для проведения клинических испытаний необходимо получить разрешение уполномоченного органа. Во-первых, необходимо предоставить документы, содержащие всю имеющуюся информацию о препарате по итогам его лабораторного и доклинического исследования, а также план проведения испытания. Во-вторых, на основании документально подтвержденных сведений Советом по этике при проводится этическая экспертиза и выдается заключение об этической обоснованности возможности или невозможности проведения клинического исследования лекарственного препарата. [2] И только на основании такого заключения Министерство здравоохранения РФ выдает разрешение на проведения клинических испытаний.
В соответствии со статьей 43 ФЗ «Об обращении лекарственных препаратов» участие пациентов является добровольным и информированным.
Для этих целей на подпись гражданину представляется информационный листок, где должны быть указаны следующие сведения:
Кратко в данном разделе должна быть представлена информация, относящаяся к безопасности, фармакодинамике, эффективности и дозозависимости эффектов исследуемого продукта. Должны быть освещены значимые различия в характере/частоте нежелательных реакций, как для различных показаний, так и для различных популяций. Должны быть описаны возможные риски и нежелательные реакции, которые можно ожидать, основываясь на накопленном опыте применения, как исследуемого продукта, так и сходных с ним продуктов. Должны быть также описаны меры предосторожности или специальные методы наблюдения, которые необходимо применять при использовании продукта с исследовательскими целями; [3]
об условиях участия граждан в клиническом исследовании лекарственного препарата для медицинского применения;
Подробный перечень информации, предъявляемый потенциальному исследуемому для обозрения, обозначен в разделе 7 «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика», он именуется брошюрой исследователя и содержит сводное изложение результатов клинического и доклинического изучения исследуемого продукта, значимых для его исследования на человеке.
На наш взгляд, кроме перечисленных выше сведений потенциальному участнику клинических испытаний должен быть представлен под роспись перечень противопоказаний для применения данного лекарственного средства с детальной расшифровкой каждого из них.
Следует отметить, что перед началом испытаний в обязательном порядке должно проводиться предварительное обследование состояния здоровья, в том числе должен быть детально и всесторонне оценен иммунный статус участника эксперимента. В противном случае невозможно будет назвать эту процедуру исследованием, поскольку не представится возможным оценить динамику показателей здоровья, в частности невозможно будет установить иммунный ответ испытуемого.
Необходимым условием является право на односторонний отказ от участия в испытании на любой его стадии без каких-либо ограничений со стороны пациента. Данная норма отражает положения Хельсинской декларации, а также конституционное право граждан, закрепленное в статье 21 — никто не может быть без добровольного согласия подвергнут медицинским, научным или иным опытам.
Субъектов испытаний в зависимости от наличия ограничений можно разделить на 3 группы.
Первую группу составляют категории граждан, которым на законодательном уровне установлен императивный запрет на участии в клинических испытаниях. В эту группу входят:
1.1. Дети сироты и дети без попечения;
1.2. Военнослужащие по призыву;
1.3. Сотрудники правоохранительных органов;
1.4. Лица, отбывающие наказания в местах лишения свободы и лица, находящиеся под стражей в следственных изоляторах.
В данный перечень, по нашему мнению, необходимо также включить пациентов, находящихся на стационарном лечении, состояние здоровья которых исходя из медицинских показателей не позволяет пациентам с онкологическими, инфекционными, аллергологическими, пульмонологическими и другими заболеваниями быть участниками клинический испытаний лекарственных препаратов.
Вторую группу составляют лица, которые могут стать субъектами клинических испытаний только при соблюдении определенных условий:
2.1. Несовершеннолетние могут участвовать в испытании только при условии, что: родители или законные представители дали на это информированное письменное согласие, проведение испытания необходимо для укрепления здоровья детей или профилактики инфекционных заболеваний в детском возрасте либо если целью такого исследования является получение данных о наилучшей дозировке лекарственного препарата для лечения детей. Такому исследованию должно предшествовать клиническое исследование лекарственного препарата для медицинского применения на совершеннолетних гражданах ( за исключением случаев, если исследуемый лекарственный препарат предназначен исключительно для использования несовершеннолетними).
2.2. Женщины в период беременности и грудного вскармливания при условии, что препарат предназначен для применения женщинами в указанный период, либо если исключается риск вреда женщине, плоду и ребенку.
2.3. Военнослужащие, при условии, что лекарственный препарат специально разработан для применения в условиях военных действий, чрезвычайных ситуаций, профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов
2.4. Лица с психическими заболеваниями могут стать субъектами клинических испытаний при наличии письменного согласия их законных представителей и при условии, что препарат предназначен для лечения психических заболеваний.
В третью группу входят граждане, не перечисленные в первых двух группах. Между тем, можно выделить отдельную подгруппу наиболее « уязвимых» граждан, такое понятие вводится пунктом 3.44 «ГОСТ Р ИСО 14 155−2014. Национальный стандарт Российской Федерации. Клинические исследования. Надлежащая клиническая практика». Прямых запретов на их участие в испытаниях нет, однако, исходя из морально-этических соображений и международного опыта, не рекомендуется привлекать в качестве испытуемых:
В частности предполагается, что на готовность указанных лиц участвовать в клиническом исследовании может излишне влиять ожидание, обоснованное или нет, или выгода, связанная с участием или негативной реакцией администрации в случае отказа от участия.
[1] п. 42 ст. 4 Федерального закона № 61-ФЗ « Об обращении лекарственных средств»
[2] Приказ Минздрава России № 986н «Об утверждении Положения о Совете по этике»
[3] «ГОСТ Р 52 379−2005. Национальный стандарт Российской Федерации. Надлежащая клиническая практика».